作者简介:李秀敏,1986年生,女,硕士,讲师,研究方向为工业催化。
研究了低成本和环保的层状锰氧化物对乙醇氧化的催化作用,通过X射线衍射、N2吸附和扫描电镜等对催化剂进行表征,考察溶剂、反应温度、氧化剂用量、催化剂用量、溶剂用量和反应时间等对乙醇催化氧化制乙醛的影响。结果表明,制备的Ca0.16MnO2·2H2O呈疏松多孔的层状结构,在氧化剂过氧化氢用量4 mL、催化剂用量0.01 g、溶剂乙腈用量5 mL、反应温度55 ℃和冷凝回流60 min条件下,乙醇转化率最高,为85.5%。
A low-cost and environmentally friendly layered manganese oxide Ca0.16MnO2·2H2O for catalytic oxidation of ethanol to acetaldehyde was studied,and was characterized by X-ray diffraction,N2-adsorption and scanning electron microscope.The effects of solvents,reaction temperatures,oxidant H2O2 dosage,catalyst dosage,solvent amounts and reaction time on the oxidation of ethanol to acetaldehyde were investigated.The results showed that the as-prepared Ca0.16MnO2·2H2O was porous with laminar structure.The highest conversion rate of ethanol was 85.5% under the optimum condition as follows:hydrogen peroxide amount 4 mL,catalyst dosage 0.01 g,solvent acetonitrile amount 5 mL,raction temperature 55 ℃ and reflux time 60 min.
乙醛是重要的有机中间体, 是香料、农药和医药等有机精细化学品合成的重要原料。合成乙醛的方法有醇氧化、羧酸还原、酰氯的罗森孟还原法和不饱和烃直接氧化等, 但仍以乙醇氧化法为主[1]。乙醇氧化法常见的催化剂有Au/CeO[2]、CuZn[3]、Ni-Fe[4]、Ag-ZSM-5[5]、MoV杂多化合物[6]、Au/Al2
锰氧化物作为最具有吸引力的无机材料, 由于其物化性质以及低成本、环境友好、活性范围广且稳定[8]而得到广泛应用。层状锰氧化物具有较大的比表面积, 对有机化合物具有高效的催化作用, 是目前研究热点。本文采用Ca0.16MnO2· 2H2O层状氧化物为催化剂, 考察溶剂种类、反应温度、氧化剂用量、催化剂用量、溶剂用量和反应时间等对乙醇催化氧化制乙醛的影响。
无水氯化钙、乙酸锰、氢氧化钾、高锰酸钾、乙腈、无水乙醇、30%H2O2均为分析纯, 天津市致远化学试剂有限公司。
Ca0.16MnO2· 2H2O制备步骤[8]:将CaCl2· 4H2O和Mn(CH3COO)2· 4H2O溶于5 mL蒸馏水中, 氢氧化钾和高锰酸钾溶于100 mL蒸馏水中; 将两种溶液混合, 得到悬浮液, 过滤, 洗涤, 60 ℃干燥12 h。干燥后的固体在空气气氛400 ℃焙烧10 h, 得到棕色粉末Ca0.16MnO2· 2H2O催化剂, 产量高于90%。
XRD表征采用德国布鲁克公司D8 Advance X射线衍射仪, 工作电压40 kV, 工作电流40 mA, 步幅0.02° 。
SEM分析采用日本日立公司S-4800场发射扫描电子显微镜, 冷场发射。
BET比表面积测定采用美国康塔公司NOVA 2000e型比表面积孔径快速分析仪。
向锥形瓶依次加入一定量的乙醇、溶剂乙腈、催化剂和30%过氧化氢, 设定反应温度, 冷凝回流反应一定时间, 反应完全后, 将反应物和产物的上清液取样分析, 得到转化率和选择率。
在以Ca0.16MnO2· 2H2O为催化剂、30%过氧化氢为氧化剂和乙腈为溶剂条件下, 考察溶剂种类、反应温度、氧化剂用量、催化剂用量、溶剂用量和反应时间等对乙醇催化氧化效果的影响, 确定最佳工艺条件。
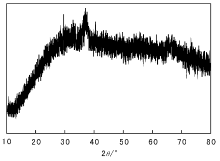
催化剂Ca0.16MnO2· 2H2O的XRD图如图1所示。由图1可以看出, 化合物的XRD数据分辨率差, 但在2θ =38° 处可观察到所有的八面体配位的锰氧化物。在2θ =11° 、25° 、36° 和65° 处可观察到具有层状结构的氧化物。2θ =11° 处的弱峰揭示了缺乏长程有序的层堆叠结构[8]。
催化剂Ca0.16MnO2· 2H2O 的SEM照片如图2所示。由图2可见, 制备的催化剂具有疏松多孔结构, 催化剂比表面积较大, 为32.98 m2· g-1。催化剂表面活性位充足, 能够吸附大量的乙醇和H2O2, 加快反应速率, 提高转化率。
锥形瓶中依次加入乙醇1 mL、溶剂10 mL、催化剂0.01 g和30%过氧化氢3.0 mL, 反应温度55 ℃, 冷凝回流反应60 min, 考察溶剂种类对乙醇氧化制乙醛的影响, 结果如表1所示。
| 表 1 溶剂种类对乙醇氧化制乙醛的影响 Table 1 Effects of different solvents on the oxidation of ethanol to acetaldehyde |
由表1可见, 溶剂为蒸馏水、乙醚、石油醚和正丁醇时, 乙醇几乎不生成乙醛, 或催化剂选择性极低; 溶剂为丙酮时, 转化率为74.36%, 转化率较高; 溶剂为乙腈时, 转化率达79.96%; 丙酮为溶剂时转化率较高, 但成本相对较高。综合考虑, 选择乙腈作为溶剂。溶剂极性越大越有利于中间体和产物的生成[9]。溶剂的极性顺序为:水> 乙腈> 乙醇> 丙酮> 正丁醇> 乙醚> 四氯化碳, 根据“ 相似相溶” 原理, 有机溶剂与乙醇、乙醛相溶性较好, 乙腈作溶剂时, 氧化乙醇转化率和收率均较高。
锥形瓶中依次加入乙醇1 mL、溶剂乙腈10 mL、催化剂0.01 g和30%过氧化氢3.0 mL, 冷凝回流60 min, 考察反应温度对乙醇氧化制乙醛的影响, 结果如图3所示。
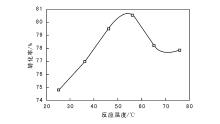 | 图 3 反应温度对乙醇氧化制乙醛的影响Figure 3 Effects of reaction temperatures on the oxidation of ethanol to acetaldehyde |
由图3可以看出, 反应温度低于55 ℃时, 乙醇转化率随温度升高而增加; 反应温度高于55 ℃, 乙醇转化率随温度升高而降低。反应温度为55 ℃, 催化剂活性最高, 乙醇转化率达最大值, 选择适宜反应温度为55 ℃。
从动力学角度看, 温度升高, 大多数化学反应速率增加, 这是因为温度升高, 其热运动速率加剧, 造成普通分子活化数量增加[10]; 另一原因是催化剂活性随温度升高而增加, 使反应速率加快。因此, 温度在一定范围升高时, 其催化剂活性增大, 有双重作用使反应速率加快, 反应转化率增加; 当温度升至一定值后再升高温度, 催化剂失活, 只有单一作用促使反应速率加快, 转化率下降。
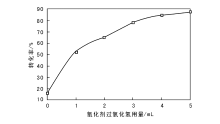
锥形瓶中依次加入乙醇1 mL、溶剂乙腈10 mL、催化剂0.01 g和30%过氧化氢, 反应温度55 ℃, 冷凝回流反应60 min, 考察氧化剂过氧化氢用量对乙醇氧化制乙醛的影响, 结果如图4所示。由图4可以看出, 乙醇转化率随着过氧化氢用量增加而提高。氧化剂过氧化氢用量低于4 mL时, 乙醇转化率明显提高; 过氧化氢用量超过4 mL时, 乙醇转化率提高幅度减小。综合考虑乙醇转化率和成本, 选择氧化剂过氧化氢用量4 mL为宜。
水溶液中过氧化氢氧化还原性由下列电势决定:
H2O2+2H++2e=2H2O h=1.77 V
H
在碱性溶液和酸性溶液中, 过氧化氢均为强氧化剂[11]。改变反应条件, 两种反应一起发生。加入过氧化氢时, 乙醇被夺去两个H+生成乙醛。随着过氧化氢体积增加, 乙醇氧化生成乙醛的速率增加, 过氧化氢达到一定体积时, 乙醇最大限度地被催化氧化生成乙醛, 反应达到平衡。
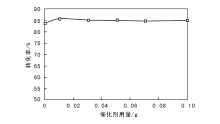
锥形瓶中依次加入乙醇1 mL、溶剂乙腈10 mL和30%过氧化氢4 mL, 在反应温度55 ℃和冷凝回流反应60 min条件下, 考察催化剂用量对乙醇氧化制乙醛的影响, 结果见图5。
由图5可见, 乙醇转化率随催化剂用量增大而提高。催化剂用量低于0.01 g时, 乙醇转化率逐渐提高; 催化剂用量高于0.01 g时, 乙醇转化率略降。因为催化剂用量增加到一定量时, 氧化剂用量达到最优, 在最优的氧化剂浓度下, 过量催化剂可能会减少吸附的H2O2密度, 导致乙醇转化率降低[12]。适宜的催化剂Ca0.16MnO2· 2H2O用量为0.01 g。
锥形瓶中依次加入乙醇1 mL、催化剂0.01 g和30%过氧化氢4 mL, 在反应温度55 ℃和冷凝回流反应60 min条件下, 考察溶剂乙腈用量对乙醇氧化制乙醛的影响, 结果如图6所示。
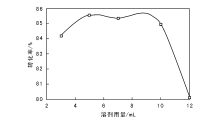 | 图 6 溶剂乙腈用量对乙醇氧化制乙醛的影响Figure 6 Effects of solvent acetonitrile dosage on the oxidation of ethanol to acetaldehyde |
由图6可以看出, 溶剂乙腈用量低于5 mL时, 乙醇转化率随溶剂用量增大而提高; 溶剂乙腈用量高于5 mL时, 随着溶剂用量增大, 乙醇转化率降低; 溶剂乙腈为5 mL时, 乙醇转化率最大。因为随着溶剂乙腈用量增大, 乙醇在溶剂中的溶解度增大, 与氧化剂和催化剂接触充分, 促进反应进行, 提高反应速率。当溶剂乙腈用量达到一定值时, 乙醇被充分稀释, 溶液浓度降低, 抑制乙醇与氧化剂和催化剂接触, 导致转化率降低[13]。
(1) 制备了一种高效、低成本和环境友好的催化剂Ca0.16MnO2· 2H2O, 在过氧化氢存在下, 将醇氧化为醛, 比MnO2催化剂更有效。
(2) Ca0.16MnO2· 2H2O催化剂属于层状锰氧化物, 呈疏松多孔结构, 具有较高的催化活性。
(3) 溶剂极性越大, 越有利于中间体和产物的生成。合适的溶剂可加快反应速率, 提高转化率, 且同时提高反应产物选择性。
(4) 在过氧化氢用量4 mL、催化剂用量0.01 g、溶剂乙腈用量5 mL和反应温度55 ℃条件下, 冷凝回流反应60 min, 乙醇转化率最高, 达85.5%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|