作者简介:

梁长海,男,1971年生,理学博士,教授,博士生导师。1994年和1997年分别获得大连理工大学工学学士和硕士学位,2001年获得中国科学院大连化学物理研究所理学博士学位;先后在中国科学院大连化学物理研究所、波鸿鲁尔大学和苏黎士瑞士联邦理工学院工作和学习;2004年获得德国洪堡学者;2007年获得高校自然科学一等奖,并入选教育部新世纪优秀人才支持计划;2008年获得高校自然科学一等奖和辽宁省自然科学二等奖,2009年和2010年连续两年分别获得大连理工大学和辽宁省优秀研究生指导教师,2010年获得SCOPUS青年科学之星新人奖,2014年入选Elsevier发布的化学工程领域中国高被引学者榜单。研究领域为先进材料和催化工程,涉及能源转化、环境保护和精细化学品合成中的催化材料和工程技术。主持或完成国家自然科学基金重点项目1项,面上项目5项,中德合作科研项目1项,教育部新世纪优秀人才计划、博士点基金和留学回国人员基金各1项,以及辽宁省、大连市及学校项目各6项;同时主持或完成企业如中国石化、香港中华煤气和中国石油等委托研发项目30多项,多项技术实现工业化生产。已发表学术论文150多篇,其中SCI收录120余篇,他引3000多次;申请发明专利70余件,授权22件;撰写4部专著中5章。
合成氨是化学工业的支柱产业, 产量大、能耗高。世界上合成得到的氨大部分直接或加工后用作氮肥, 也可制造硝酸、铵盐和氰化物等无机化合物, 各种胺和磺胺等有机化合物也以氨为原料。此外, 氨可用作冷冻剂, 在其他很多化工生产中, 氨也是不可缺少的原料, 对国民经济与国防具有重大意义。
19世纪, 含氮化合物主要来源于天然硝石和煤。20世纪初, 随着对氮化合物的需求日益增长, 促使人们寻求直接利用空气中的氮制取氮化合物的方法。1902-1913年, 人类先后发明了3种固定大气中氮的方法:电弧法、氰氨基钙法和氨合成法[1, 2]。
电弧法是模仿自然界放电过程, 将空气在放电的高温下, 使空气中的氧与氮直接合成一氧化氮, 再经空气氧化成二氧化氮, 用水吸收二氧化氮而制得硝酸。固定1 kg氮需消耗(50~80) kW· h电能, 巨大的能量消耗限制了其工业应用。
氰氨基钙法是将氧化钙与碳在高温下作用生成碳化钙, 再与氮气作用制得氰氨基钙。氰氨基钙可用作氮肥, 也可制氰化物及用作制取许多含氮有机化合物的原料。固定1 kg氮需消耗(16~18) kW· h电能, 比电弧法要低很多。在第一次世界大战前氰氨基钙法为固定空气氮的主要方法。
直接催化氨合成法由Haber和Bosch于20世纪初研究成功。1913年德国建立了世界上第一个直接氨合成工厂。1934年后, 该法才成为固氮工业的最主要方法。固定1 kg氮需消耗(7~8) kW· h电能, 已接近理论最小值(约6.1 kW· h· kg-1)。
在数以千计的工业催化剂中, 氨合成催化剂占有非常特殊而重要的位置。1909年研究成功的氨合成催化剂实现了工业史上第一个高压催化过程, 是催化科学与技术发展史上的一个里程碑, 标志着工业催化新纪元的开端。几年后出现的多相催化甲醇合成和煤液化等高压反应技术则成为有机化学领域中的基本手段。100多年来, 氨合成催化剂一直是多相催化领域中众多基础理论研究的起点。氨合成催化剂的发展史是催化科学与技术发展史的缩影。氨合成催化剂的研究和开发仍然值得当今催化科学与技术的研究者借鉴。
以氨合成为中心的合成氨工业在国民经济中具有举足轻重的地位。合成氨工业经过100多年的发展, 尽管基本工艺原理和生产工序无多大改变, 但技术日趋完臻, 能耗已接近理论最小值。其特点表现在:(1) 单套装置的生产规模不断增大, 目前单套合成氨装置已达到1 850 t· d-1以上; (2) 催化剂的不断改进和创新大幅度提高了生产效率, 降低了能耗。如氨合成反应压力由早期的(20~30) MPa已可以降至(8~10) MPa条件下进行; (3) 合成氨工业的能量系统优化和分级利用大幅度降低了能耗。
合成氨生产过程主要分为原料气制取、原料气净化和氨合成三部分。其中涉及的主要化学反应均是通过多相催化过程完成, 催化科学与技术在合成氨工业中起着至关重要的作用。
氨合成的氮气来源于空气, 要么在制氢时加入空气, 要么采用深冷分离制备纯氮气, 在氨合成前与氢气混合加入。氨合成的氢气主要由煤、石油、天然气和生物质等为原料制取。工业上通常在高温下将上述原料与水蒸汽和空气等作用制得含氢和一氧化碳等组分的原料气。如以煤和生物质为原料, 可以通过气化或热解得到富含氢气的原料气; 石油或其馏分可以水汽重整得到原料气; 而天然气则可以水汽重整或部分氧化得到原料气。
原料气中的一氧化碳与水蒸汽反应生成氢和二氧化碳, 称为一氧化碳变换。其反应式如下:
CO+H2O→ CO2+H2
一氧化碳变换反应是一个体积不变的放热反应, 反应平衡不受压力影响, 但降低温度、增加水蒸汽或减少二氧化碳的含量, 均能使一氧化碳平衡浓度降低。一氧化碳变换催化剂根据活性温度和抗硫性能分为铁铬系、铜锌系和钴钼系等。为提高一氧化碳转化率, 一般采用过量水蒸汽。温度是控制一氧化碳变换反应最重要的条件。随着变换反应的进行, 会有大量反应热放出, 使催化剂床层出口温度上升。对一氧化碳浓度高的原料气, 通常采用两段变换工艺流程, 以尽可能降低变换气中的一氧化碳浓度。一般大量一氧化碳在一段较高温度下与水蒸汽反应, 然后进行冷却再进入较低温度下二段反应器进行变换反应, 最大限度转化为氢气和二氧化碳。
原料气中含有的少量含硫化合物、碳氧化物及水蒸汽等都对生产过程中所用的催化剂有害, 需在进入氨合成反应器前去除。一般将脱除含硫化合物的过程简称为脱硫; 脱除二氧化碳的过程简称为脱碳。残余的少量一氧化碳、二氧化碳和水蒸汽则在最后通过甲烷化反应和干燥过程去除。
原料气中含硫化合物主要是硫化氢, 也有二硫化碳、氧硫化碳、硫醇、硫醚和噻吩等有机硫。脱硫方法根据脱硫剂的物理形态分为干法和湿法; 根据与脱硫剂的作用原理可分为物理法和化学法。
干法脱硫包括:采用活性炭吸附脱除硫醇等有机硫化物及少量的硫化氢; 采用氧化锌为吸附剂脱除除噻吩外的硫化氢及各种有机硫化物; 采用钴钼或镍钼加氢催化剂将有机硫化物转化成硫化氢, 再用脱硫剂如氧化锌等将生成的硫化氢脱除。该方法可将总硫含量脱除到0.5× 10-6以下, 广泛用于烃类蒸汽转化法生产的合成氨原料气脱硫。
湿法脱硫是指采用各种溶液脱除含硫化合物, 包括物理吸收法和化学吸收法。其优点是能脱除大量的硫化氢; 脱硫剂是液体物料, 便于输送, 可以再生, 可回收硫; 流程是一个连续脱硫的封闭循环系统, 在操作中只需补加少量物料补偿损失。
物理吸收法:物理吸收剂有甲醇、碳酸丙烯酯和聚乙二醇二甲醚等, 不仅能脱除硫化氢、氧硫化碳和二硫化碳等, 也能选择性地吸收二氧化碳。吸收溶液可再生, 且硫化氢可回收。
化学吸收法:一般通过均相催化氧化将溶液中所吸收的硫化氢氧化成单质硫, 脱硫溶液可以再生利用。目前, 常用的两个体系为以氨水作脱硫剂, 对苯二酚作氧化催化剂以及以碳酸钠作脱硫剂, 2, 6-蒽醌二磺酸或2, 7-蒽醌二磺酸作为溶液催化剂。
原料气脱碳方法可分为三类:(1) 物理吸收法。主要有甲醇洗涤法、碳酸丙烯酯法和聚乙二醇二甲醚法等, 具有净化度高、能耗低、回收二氧化碳纯度高等优点, 且可选择性地脱除硫化氢, 是工业上广泛采用的脱碳方法; (2) 化学吸收法。具有吸收效果好、再生容易, 同时能脱硫化氢等优点, 主要有氨水吸收法、乙醇胺法和催化热钾碱法, 后者脱碳反应式为:K2CO3+CO2+H2O→ 2KHCO3。为提高二氧化碳吸收和再生速率, 可在碳酸钾溶液中添加某些无机或有机物作活化剂, 并加入缓蚀剂以降低溶液对设备的腐蚀; (3) 物理-化学吸收法。以乙醇胺和环丁砜混合溶液作为吸收剂, 称为环丁砜法, 因乙醇胺是化学吸收剂, 环丁砜是物理吸收剂, 故称为物理与化学效果相结合的脱碳方法。
原料气经一氧化碳变换、脱硫和脱碳后, 尚含有少量一氧化碳和二氧化碳, 在进入氨合成反应器前, 需进一步加以脱除使其总含量少于10× 10-6。脱除少量一氧化碳和二氧化碳方法包括:
(1) 铜氨液吸收法。在高压、低温下用铜盐氨溶液吸收一氧化碳并生成络合物, 然后将溶液在减压和加热条件下再生:
[Cu(NH3)2]++CO+NH3→ [Cu(NH3)3CO]+
由于吸收溶液中有游离氨, 故还可以同时将气体中的二氧化碳脱除:
NH4OH+CO2→ NH4HCO3
(2) 液氮洗涤法。利用液氮能溶解一氧化碳和甲烷等的物理性质, 在深度冷冻的条件下将原料气中残留的少量一氧化碳和甲烷等彻底去除。其适用于设有空气分离装置的净化流程, 也可用于焦炉气分离制氢的流程。
(3) 甲烷化法。在镍催化剂存在下使一氧化碳和二氧化碳加氢生成甲烷:
CO2+4H2→ CH4+2H2O
CO+3H2→ CH4+H2O
由于甲烷化反应为强放热反应, 因此对气体中一氧化碳和二氧化碳含量有限制。甲烷化法流程简单, 可将原料气中碳的氧化物脱除到10× 10-6以下。以天然气为原料的合成氨厂大多采用, 但甲烷化反应中消耗氢气, 且生成对合成氨无用的惰性组分甲烷。
水蒸汽对氨合成催化剂有毒害作用。被水蒸汽饱和的新鲜氮氢混合气在进入合成系统前需去除水蒸汽。工业上采用分子筛为吸附剂将水分和微量的二氧化碳脱除, 分子筛经加热再生后再用。
不同压力下氨合成的平衡收率(出口浓度)与温度的关系(氢氮计量比)如图3-1所示。
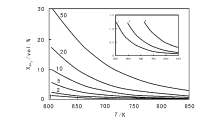 | 图 3-1 不同压力下氨合成的平衡收率(出口浓度)与温度的关系(氢氮计量比)[7]内插图为1、2、5 bars条件下的放大图 |
N2(g)+3H2(g) → 2NH3(g)
△
△
△
氨合成反应是无副反应、放热和体积减少的可逆反应。化学平衡常数随反应温度降低而增加, 而反应速率常数随反应温度降低而降低。在较低温度范围, 平衡常数很大; 温度对反应速率常数的影响显著, 反应速率随温度升高而增大。但随着温度逐渐升高可逆放热反应常数降低, 反应速率随温度增加量变小。当温度到达某一数值时, 反应速率随温度增加量为零。再继续升高温度, 温度对平衡常数的影响成为主要, 反应速率随温度升高而减少。由于氨合成反应是一个体积减少的反应, 无论从反应热力学还是动力学来讲, 提高反应压力都有利。催化剂的活性(出口氨浓度)与反应压力在一定范围内呈线性关系, 压力越高, 出口氨浓度越高。
氨合成熔铁催化剂有氧化态和还原态。由磁铁矿和少量助催化剂经过混合、熔炼、冷却、成型或破碎所制得的催化剂呈氧化态, 对氨合成反应没有活性; 而将氧化态催化剂用氢气或氮氢混合气还原, 使其中的主要成分Fe3O4转化为金属铁, 便成为还原态催化剂, 对氨合成反应才有活性。
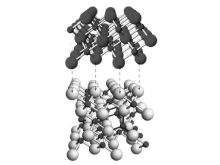
氧化态熔铁催化剂包含主催化剂前驱体、助催化剂和少量杂质, 如图3-2所示。主催化剂前驱体为Fe3O4, 含量约90%; 助催化剂是一些难以还原的金属氧化物如Al2O3、K2O、CaO、MgO和SiO2等。
 | 图 3-2 熔铁氨合成催化剂[8] |
由于熔铁催化剂原料价廉易得, 制造工艺简单, 产品机械强度、抗毒性及热稳定性好, 人们试图通过改变主催化剂的种类和数量来提高反应性能, 但效果并不明显。目前工业上大量使用的熔铁催化剂组成与1913年德国BASF的催化剂没有根本不同[9]。大量的研究使得熔铁催化剂成为世界上研究最明晰的催化剂之一。工业应用的熔铁催化剂主要有添加稀土氧化物和添加氧化钴两类。熔铁催化剂的主催化剂前驱体是Fe3O4。刘化章等[5]系统研究了铁的不同氧化物及其混合物前驱体与氨合成活性的关系, 发现具有维氏体结构的Fe1-xO前驱体得到的熔铁催化剂具有更高的活性, 开创了铁基催化剂的新阶段, 使低温氨合成铁基催化剂取得了飞跃性进展。
由铁氧化物前驱体还原得到的α -Fe是氨合成反应的主催化剂。铁氧化物前驱体还原得到的催化剂在合成氨过程中失活很快。作为助催化剂的Al2O3、MgO、SiO2、K2O和CaO等难熔金属氧化物不被还原, 对氨合成不具有催化活性。其作用是改善α -Fe催化活性, 增强耐热性和抗毒能力, 延长使用寿命。
催化剂中加入Al2O3后, 它能与Fe2O3形成固溶体。当催化剂还原时, 氧化铁被还原为活性铁, 而Al2O3不被还原, 起到骨架作用, 从而防止铁微晶长大, 增大了催化剂的比表面积, 提高了催化性能(图3-3)。例如, 含2%Al的铁催化剂, 比纯铁催化剂的比表面积大约4倍。但Al2O3的加入会降低催化剂的还原速率, 并使催化剂表面生成的氨不易解吸。
在还原过程中, MgO与Al2O3有相似之处, 也能防止活性铁的微晶进一步长大。但其主要作用是增强催化剂对硫化物的抗毒能力, 并保护催化剂在高温下不致因晶体破坏而降低活性, 故可延长催化剂寿命。熔铁催化剂用熔融法制造, 由于熔融态氧化铁黏度大, Al2O3不易分布进去。加入CaO后, 可降低熔点和黏度, 有利于Al2O3的均匀分布, 使催化剂的活性、抗毒能力和热稳定性都有所提高。
SiO2是磁铁矿的杂质, 具有中和K2O等碱性组分与提高催化剂抗水毒害和耐烧结的作用。
 | 图 3-3 图 3-3 铝含量对熔铁催化剂总比表面积(N2物理吸附, ■)、金属表面积(CO化学吸附, ●)和氨合成活性(单助剂熔铁催化剂, ▽) 的影响[7] |
Al2O3、MgO、CaO和SiO2等高温难熔氧化物属于结构助催化剂, 主要有以下作用:均匀分布在催化剂中; 高温难熔氧化物, 自身不被还原, 使用时不会烧结, 能够阻止α -Fe微晶颗粒长大; 增大催化剂的物理和化学表面积。
K2O等碱金属氧化物的作用不同于结构助催化剂。它们的加入降低了催化剂抗热和耐毒能力, 但大幅度增加了比活性, 被称为电子助催化剂。CO2的化学吸附研究显示, 加入K助催化剂使得α -Fe微晶表面上碱性表面覆盖率大幅度增加, 表明熔铁催化剂还原后K2O或KOH富集在α -Fe微晶表面上。Stongin D R等[10]研究了K的加入对Fe(111)、Fe(110)和Fe(100)上氨合成活性的影响, 发现Fe(110)上无论是否加入K, 对氨合成均无活性, 而Fe(111)和Fe(100)加入K后氨合成速率大幅度提高, 并随着转化率的增加, 促进效应更加明显, 如在0.3%的转化率下, 加入K后氨合成速率增加了两倍。同时K的加入改变了NH3和H2的反应级数, 而反应活化能不变, 说明氨合成反应机理没有改变。
熔融法是氨合成催化剂现代化工业生产的通用方法, 其他方法用于特殊范围内。如法本公司(I.G. Farben AG)采用亚铁氰化钾、亚铁氰化钾铝或亚铁氰化钙等亚铁氰化物在氢气存在下进行热分解, 得到中间产物碳化铁和氮化铁, 再用通常的方法活化得到氨合成铁基催化剂, 仅在局部地方应用[11]; 也有采用沉淀-烧结法制备成型催化剂, 即将氨气通入铁和铝的硝酸盐溶液, 使得氢氧化铁和氢氧化铝共同沉淀, 再加入其他促进剂焙烧成氧化物。沉淀-烧结法是主要的非熔融工艺生产成型催化剂的方法[12]。
工业用铁基氨合成催化剂均是按传统的熔融法工艺制造, 所得催化剂称为熔铁催化剂。工艺简单易行, 成本低廉, 性能优良。尽管不同公司制造的催化剂化学组分和催化性能有所不同, 但制备工艺基本相同。制备工艺主要包括如下步骤:原料精制、物料配比与混合、物料熔融、物料的排出和冷却、破碎冷却物料进行筛分以及预还原等。简单的工艺流程如下[2]:将磁铁矿经磁选工艺除去SiO2、TiO2、S和P等杂质后, 根据需要计量配入助催化剂(Al2O3、KNO3、CaCO3等), 在混合机中混合均匀后置于电熔炉中, 在(1 600~3 000) ℃下熔融后, 将熔浆放入冷却槽中冷却, 再粉碎过筛得到不同粒级的颗粒产品。需要进行预还原的催化剂再送至还原工段, 用氮氢混合气进行预还原得到预还原的催化剂。其中原料精制、Fe2+/Fe3+比的控制和凝固冷却的速率是熔融法制造铁基氨合成催化剂的关键步骤。
精制磁铁矿在高温熔融条件下与还原剂发生下列化学反应:
Fe2O3+还原剂→ Fe3O4
Fe3O4 +还原剂→ FeO
由于精制磁铁矿中Fe2O3含量很低, 因此Fe3O4 基催化剂的制备主要是物理熔融过程。精制的天然磁铁矿中Fe2+/Fe3+比一般低于0.5, 而工业用Fe3O4 基催化剂要求Fe2+/Fe3+比为0.5~0.7。制备过程中Fe2+易被空气中的氧气氧化为Fe3+, 从而使得Fe2+/Fe3+比进一步降低。
2Fe3O4 +1/2O2→ 3Fe2O3
因此在熔融过程中需加入还原剂如金属铁、焦炭等调节Fe2+/Fe3+比, 反应如下:
4Fe2O3+Fe→ 3Fe3O4
Fe2O3+Fe→ 3FeO
6Fe2O3+C→ 4Fe3O4+CO2
2Fe2O3+C→ 4FeO+CO2
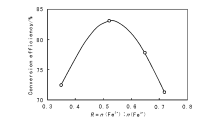
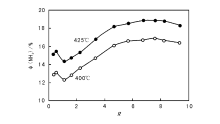
Fe2+/Fe3+比是熔铁催化剂制备过程中的主要控制指标。Almquist J A等[13]最早比较了纯铁与含助剂铁催化剂的还原前氧化度与氨合成活性的关系, 发现Fe2+/Fe3+比接近0.5时, 组成接近Fe3O4 相的催化剂具有最高的活性。Bridger G L等[14]进一步研究了Al2O3-K2O双助剂熔铁催化剂, 在压力10.13 MPa、温度450 ℃和空速1× 104 h-1条件下, Fe2+/Fe3+比为0.52时催化剂的转化效率(出口氨浓度与平衡氨浓度之比)最高(图3-4)。 刘化章等[5, 15]研究了催化活性与铁氧化物及其混合物(以R值表征)的关系, 获得如图3-5所示的驼峰形活性曲线。在R< 1时, 催化活性与R值的变化关系同经典的以磁铁矿相组成的传统催化剂研究结果相一致; 当催化活性越过R=1时的低谷后, 又开始升高; R=3.33时, 催化剂母体开始形成维氏体Fe1-xO相结构, 其活性已明显超过R=0.5的传统催化剂; 当R> 5时, 催化剂母体形成了完全的维氏体结构, 熔铁催化剂活性才真正达到最高值。
作为助催化剂加入的KNO3、CaCO3等在高温下发生分解反应:
2KNO3→ K2O+NO+NO2+O2
CaCO3→ CaO+CO2
Al2O3、K2O、CaO等又会与铁的氧化物生成各种复合氧化物, 如:
FeO+Al2O3→ FeAl2O4
K2O+Al2O3→ 2KAlO2
K2O+Fe2O3→ 2KFeO2
CaO+Fe2O3→ 2KFeO2
由磁铁矿和少量助催化剂经过混合、熔炼、冷却、成型或破碎制得的催化剂呈氧化态, 对氨合成反应没有活性。氧化态的催化剂需要用氢或氮氢混合气将其还原成α -Fe后才具有催化活性。还原催化剂的活性和寿命不仅与催化剂的化学组成和制备过程有关, 而且催化剂还原过程也至关重要。催化剂还原过程涉及热力学和动力学两方面的问题。
氨合成铁基催化剂按如下反应进行还原:
Fe3O4(s)+4H2(g)→ 3Fe(s)+4H2O(g)
Δ Ho=142 kJ· mol-1
在温度200 ℃、300 ℃、400 ℃、500 ℃和600 ℃时, 上述化学还原反应的平衡常数分别为0.013、0.044、0.107、0.214和0.283。
还原反应是一个吸热的可逆反应。提高反应温度, 有利于金属铁的生成, 但也加速了铁微晶的长大, 从而降低氨合成催化剂活性。气相中水汽可将金属铁重新氧化为Fe3O4 。一般还原压力对活性影响不大, 增加还原气体空速和减少水汽浓度有利于活性提高。
对于Fe3O4 , 在温度444 ℃,
熔铁催化剂的还原是气固相反应, 还原过程涉及外扩散、界面反应和内扩散等步骤。在还原的不同阶段, 还原过程的速率控制步骤不同。一般认为熔铁催化剂的还原分为三个阶段:开始为界面反应控制阶段, 一旦形成金属铁层, 气体扩散成为控制性因素, 后期还原速率大幅度下降源于还原气体通过金属铁层的气阻增大。球形颗粒熔铁催化剂的还原速率方程可写为:
(KP/r0d0)(c0-c0e)t=[1-(1-R)1/3]+(r0KP/Kd)[1/2-R/3-(1-R)2/3/2]
式中, t为还原时间; r0为熔铁催化剂颗粒初始半径; c0为熔铁催化剂表面气体浓度; c0e为气体平衡浓度; KP为界面反应速率常数; Kd为气体扩散系数; R为还原度, 是催化剂中已除去的氧量与可除去的氧量百分比; d0为熔铁催化剂的初始密度。
当反应由界面控制时, KP≪Kd或者KP/Kd≈ 0, 则还原速率方程可写为:
(KP/r0d0)(c0-c0e)t=1-(1-R)1/3
则t=r0d0[1-(1-R)1/3]/[KP(c0-c0e)]
显然, 在相同条件下具有相同密度的催化剂颗粒达到一定还原度所需的时间t与催化剂颗粒半径r0成正比关系。
当反应为气体扩散控制时, KP≫Kd或Kd/KP≈ 0, 则还原速率方程可写为:
(Kd/r0d0)(c0-c0e)t= r0[1/2-R/3-(1-R)2/3/2]
则t=
显然, 在相同条件下具有相同密度的催化剂颗粒达到一定还原度所需的时间t与催化剂颗粒半径
除催化剂颗粒影响外, 熔铁催化剂还原过程还受温度、压力、气体组成和助催化剂等影响。还原温度对催化剂的活性影响很大, 只有达到一定温度还原反应才开始进行, 提高还原温度能加快还原反应的速率, 缩短还原时间; 但还原温度过高, 生成的α -Fe晶粒大、比表面积小、活性低。因此, 实际还原温度一般不超过正常使用温度。压力不影响还原反应的平衡, 但压力对还原反应速率影响是多方面的。提高压力可以提高氢的分压, 有利于提高还原反应速率, 并能促进氨合成反应进行, 增加还原反应的热量。但压力的提高, 也会提高微孔中的水汽浓度, 使催化剂反复氧化还原, 影响催化剂活性, 因而还原过程的不同阶段应控制不同的压力。还原主期前一般控制在(5~10) MPa, 还原后期为提高下层温度, 压力可达12 MPa。提高空速有利于还原反应, 因为提高空速可以降低还原气体中的水汽浓度, 减小轴向温差, 提高催化剂活性。一般在还原初期采用较低空速, 而进入出水旺期可用较大空速。提高还原气体中氢气浓度和降低水蒸汽含量, 对还原反应有利。尤其是水蒸汽含量高, 可以把已还原的催化剂反复氧化, 造成晶粒变大, 活性降低。
氨合成催化剂的还原可分为塔内直接还原和塔外预还原两种。塔内直接还原早期大量使用, 但是由于还原条件和氨合成条件不同, 使得还原质量难以保证、还原时间长影响正常生产以及还原过程中生成大量稀氨水等不足, 塔外预还原催化剂应运而生。所谓预还原催化剂是指按照理想条件预先还原催化剂并经过钝化处理, 装入氨合成塔经简单还原即可使用的氨合成催化剂。
氨合成催化剂的预还原过程包括还原和钝化两步。还原步骤发生的化学反应如下:
Fe3O4 +4H2→ 3Fe+4H2O
FeO+H2→ Fe+H2O
钝化步骤发生的化学反应如下:
Fe+1/2O2→ FeO(氧化膜)
如前讨论的还原条件对氨合成催化剂性能的影响, 还原过程中要严格控制气体中的水汽浓度和同平面温度差。还原初期采用“ 四高” 和“ 四低” 控制原则, 即高加热功率、高空速、高压力、高氢气浓度; 低水汽浓度、低同平面温度差、低温多出水和低CO和CO2浓度。在塔内直接还原很难做到的“ 分层还原” , 而在塔外预还原中很容易实现。
钝化是将含有少量氧气的氮气通过还原过的催化剂, 使得金属铁表面发生缓慢的氧化, 生成一层很薄的氧化铁保护层, 避免催化剂接触空气时发生自燃而烧毁。氮化处理可以对钝化处理起缓冲作用, 使活泼的金属铁在氨存在下生成不稳定的氮化铁, 在钝化时氧把氮化铁中的氮取代出来生成氧化物。该过程比金属铁直接氧化缓和的多, 活性和机械强度损失较小。
钝化过程生成的氧化膜的氧含量占氧化态催化剂中总含氧量的比值称为钝化度。钝化度一般控制低于15%。钝化度太低, 氧化膜太薄, 表明钝化不足。催化剂在接触空气会发生自燃; 钝化度太高, 氧化膜太厚, 表明钝化过度。催化剂在使用时经历反复的还原-氧化-还原过程, 使晶粒长大、活性降低。因此预还原的关键在于控制氧化膜的厚度。南京化学工业公司[6]在熔铁催化剂预还原方面开展了大量研究, 推荐的钝化条件如下:室温~100 ℃, 氮气+空气, 空速(1 000~5 000) h-1, 分5个阶段进行, 各阶段氧含量依次为0.05%、0.10%、1.00%、8.00%和21.00%。
3.3.4.1 氧化态熔铁催化剂的结构
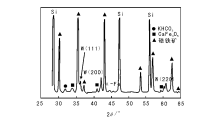
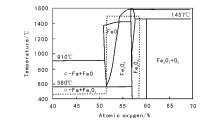
由磁铁矿和少量Al2O3、MgO、K2O、CaO等助催化剂熔融制得的氧化态催化剂, 经高分辨X射线粉体衍射(图3-6)分析显示, 其主要物相为磁铁矿(Fe3O4 )和维氏体(FeO)。此外一些较弱的衍射峰可以归属为CaFe3O5、KHCO3和α -Fe[16]。显然从Fe-O相图中可以看出, 熔铁催化剂中Fe3O4 、FeO和α -Fe三相共存的介稳态是很独特的(图3-7)。因此, 在拓扑化学控制的还原过程中很容易形成非均一的金属铁。
能量X射线能谱分析显示熔铁催化剂除有Ca、K、Fe外, 还含有Si、Ti、Al等。由于它们以非晶微结构存在, 因此在图3-6的高分辨X射线粉体衍射谱没有观测到。Al的氧化物晶相未能检测到和磁铁矿晶格常数的减小, 暗示了FeAl2O4等固溶体的形成[16]。
作为熔铁催化剂的主要成分, 磁铁矿Fe3O4 具有类似于尖晶石MgAl2O4的结构。基本晶胞由8个Fe3O4 分子组成。Fe3O4 是独立的晶相, 绝非氧化物FeO和Fe2O3的混合物。富铁的维氏体和贫铁的磁铁矿结构如图3-8所示[7]。两种结构由氧离子密堆积结构决定。在氧离子的密堆积结构中存在两种空隙:八面体空隙和四面体空位。优先位置匹配结构的密堆积结构如图3-8中箭头所示。维氏体中的铁离子占居于八面体空隙, 而四面体空位不被占居。透视图显示铁离子的八面体配位和面心立方结构的氯化钠中的钠离子排列一致。在磁铁矿中, 八配位铁离子和四配位铁离子共存, 并且八面体空隙和四面体空位没有完全被占满, 因此磁铁矿中的空位为助催化剂的掺杂提供了有利的结构条件。各种助催化剂如Al2O3、K2O、CaO、MgO、SiO2等的金属离子在磁铁矿中填充、取代或形成固溶体就构成了工业氨合成熔铁催化剂的整体结构。
 | 图 3-8 磁铁矿(Fe3O4 )和维氏体(FeO)的结构[7] |
3.3.4.2 还原态熔铁催化剂的结构
熔铁催化剂的孔结构在还原脱氧过程中形成, 还原前催化剂可视为无空隙固体。还原后磁铁矿Fe3O4 的氧原子被除去, 形成体心立方结构的α -Fe微晶粒彼此各以部分晶面联结, 形成一个多孔的骨架。由于氧被除去, 颗粒内部形成许多相互连通的小孔。各种助催化剂以氧化态存在, 分布在微晶之间, 而K2O主要富集在α -Fe的表面上。
熔铁催化剂还原后得到的α -Fe微晶晶粒一般为(20~50) nm, 总比表面积为(1~20) m2· g-1, 其微晶晶粒大小与还原条件有关。例如对于双助剂(6.4%Al2O3-0.8%K2O)的熔铁催化剂在450 ℃氢气还原下, 随着还原度的提高, 平均孔径几乎不变, 而总比表面积逐渐增加, 金属比表面积当接近完全还原时才迅速增加。当增加还原温度至650 ℃, 完全还原后总比表面积降低, 平均孔径增加。同时还原过程中水蒸汽的存在使得还原后得到的α -Fe微晶晶粒变大[17]。
铁基氨合成催化剂还原后都呈现α -Fe微晶结构, 但催化性能差别很大。除助催化剂在结构和电子方面促进外, α -Fe微晶晶面决定了氨合成的本质活性。图3-9显示了金属Fe单晶的(111)、(110)、(100)、(211)和(210)取向的理想表面结构示意图以及各晶面取向上氨合成反应速率。在低米勒指数晶面上Fe(111)晶面氨合成活性最高, Fe(100)晶面次之, Fe(110)晶面几乎没有活性, 其相对活性比为418:25:1。这与N2在Fe(111)、Fe(100)、Fe(110)上的化学解离速率一致。对Fe(211)和Fe(210)进一步研究发现, 氨合成活性顺序为Fe(111)> Fe(211)> Fe(100)> Fe(210)> Fe(110), 表面粗糙度顺序为Fe(210)> Fe(111)> Fe(211)> Fe(100)> Fe(110), 功函数顺序为Fe(210)< Fe(111)< Fe(211)< Fe(100)< Fe(110)。显然氨合成活性与晶面的功函数和表面粗糙度没有直接关系[10, 18, 19, 20, 21]。
 | 图 3-9 金属Fe单晶的(111)、(210)、(100)、(211)和(110)取向的理想表面结构示意图以及各晶面取向上氨合成反应速率[19] |
在Fe(111)和Fe(211)上氨合成的高活性被归因于C7活性位。所谓C7活性位是指有7个最邻近原子的表面铁原子。如图3-9所示Fe(111)和Fe(211)具有较多的C7活性位[18]。忻新泉等[22]对C7活性位对N2活化进行了理论计算, 结果显示C7活性位对N≡ N中π 键大幅度减弱。C7活性位在晶面不明确的金属簇中也得到证实, 如Boudart M等[23]发现氨合成的转换频率(TOF)随铁的颗粒尺寸增大, 增加了35倍, 表面C7活性位的浓度随着金属簇的粒度增加而增加。
固体表面在作用力的推动下, 表面原子向新的平衡位置弛豫, 使平行于表面的原子排列的周期结构发生变化, 称为表面重构。Strogin D R等[10, 20]研究了AlxOy和K在Fe(111)、Fe(100)、Fe(110)上对氨合成活性的影响, 结果表明, 在AlxOy和水蒸汽存在下Fe(100)和Fe(110)重构的表面具有与清洁的Fe(111)同样的氨合成活性, 并且可保持活性4 h, 而没有AlxOy存在的重构表面虽然也和清洁的Fe(111)同样的氨合成活性, 但只能保持1 h。Fe(111)用水蒸汽处理后得到重构表面的氨合成活性略有下降。在水蒸汽处理条件下, K单独在铁的晶面吸附或者与AlxOy共吸附均未显示出促进效应。
AlxOy在Fe表面上首先生成铝酸铁FeAl2O4。在氨合成反应条件下, 暴露的Fe(111)或Fe(211)晶面生长取向是重构表面的模板。水蒸汽使铝酸铁的铁晶粒生长取向沿(111)晶面生长。NH3存在下无论AlxOy是否存在, 所有铁表面都有可能重构成Fe(211)晶面[20]。
 | 图 3-10 Fe单晶和重构AlxOy/Fe晶面上的氨合成反应速率 [20] |
发生表面重构现象的原因与催化材料本身和反应物有关。从催化材料本身而言, 为了减少表面能, 表面较大原子会沿表面移动到新的定位, 导致新的表面结构。当固体表面吸附反应物后, 其表面晶格原子可能发生变化, 呈现于吸附前不同的构造。但不论哪种构造现象, 均有两个特点:(1) 从一种表面结构变为另一种表面结构时, 其体相结构基本不变; (2) 两种表面结构之间能量差不太悬殊, 原子只要克服不高的能垒即可在表面迁移。所以吸附外来原子后, 可以使表面结构发生变化。
3.4.1.1 H2的吸附与活化[24]
H2在金属表面的化学吸附甚至在室温下都是解离吸附。在Fe(110)上H2的解离过程如此之快以致检测不到H2吸附态和能量变化。形成原子H的总包活化能垒约3 kJ· mol-1。H2的化学吸附能在多晶和单晶上不同, 并且化学吸附能值与覆盖度相关。化学吸附能可以推测出表面的非均一性和H-H相互作用。在Fe(111)、Fe(100)、Fe(110)上的初始化学吸附能分别为88 kJ· mol-1, 100 kJ· mol-1和109 kJ· mol-1。化学吸附H在铁表面的缔合和脱附温度在500 K以下, 这也说明在氨合成条件下, 脱附过程足够高效, 以至于吸附-脱附平衡决定了表面的原子H浓度。上述的结果基于如下假设:超高真空下得到的数据不仅可以外推到氨合成的温度, 而且也可外推到反应压力; 在H-Fe系统中没
有压力诱导的相变化。H-Fe的共价键本质与化学吸附能以及在低于费米边约5.5 eV的H-Fe键态可以并立。理论计算和实验确认的小的偶极距证实了H与Fe相互作用的复杂性。
3.4.1.2 N2的吸附与活化[25, 26, 27, 28, 29]
N2的吸附与活化对氨合成反应机理研究至关重要, 然而N2在过渡金属表面的吸附情况复杂。对于氮分子在Fe表面上吸附是分子吸附还是解离吸附均有实验证据支持。如Ozaki A等[26]采用红外光谱研究N2在Ru-K/Al2O3吸附时发现, 在2 020 cm-1处存在稳定的有IR活性的氮分子物种, 且用氢气处理可以转化为氨。同时采用N2同位素进行吸附, 进一步证实了该物种为端基吸附(Ru— N≡ N)。拉曼光谱和红外光谱对铁催化剂上氨合成反应研究发现, 铁催化剂主要化学吸附物种是分子态的N2, 而不是原子态的N。同时在双助剂的铁基催化剂上H2/N2吸附后在200 ℃脱附只能检测到N与NH, 表明N2在铁基催化剂上发生了解离吸附。
Ertl G等[29]对N2在Fe(111)上的吸附进行了详细研究, 图3-11给出了N2在Fe(111)晶面上吸附物种的N1s光电子谱和相应的示意势能图。N2在Fe(111)晶面上有3种吸附物种, 即分子吸附态γ 和α 以及解离吸附态β 。γ 吸附态可以进一步转化为α 吸附态, 直至变成解离的β 吸附态。
 | 图 3-11 N2在Fe (111)晶面上的吸附物种的N1s光电子谱 [27] |
最近, Mortensen J J等[28]采用密度泛函理论计算了N2在Fe(111)吸附的能量途径, 研究发现N2在Fe(111)晶面上存在5种吸附态, 4种以分子吸附态存在(如图3-12所示), 1种以原子吸附态存在。除了实验观测到的γ 、α 和β 外, 还有分子吸附态δ 和α ’ 。吸附在第一层铁原子顶端的N2与铁结合最紧, 对应物理吸附态γ ; 吸附在第一层铁原子顶端的N2与铁结合能比γ 高, 称为δ 吸附态。此外还存在两个与表面平行的吸附态, 不对称结构的成为α 态, 具有对称结构的称为α ’ 态。由分子吸附态到原子吸附态有两条途径:一条途径γ → δ → α → α ’ → β , 此过程无焓变, 但有熵变; 另一条途径直接吸附成α ’ 态, 然后解离成β 态, 此过程需要很高的活化能。
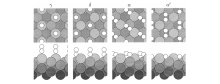 | 图 3-12 N2在Fe (111)晶面上的分子吸附态[28] |
除了贵金属, 每个元素都可以形成氮化物。Ⅰ A和Ⅱ A生成离子型氮化物。Li与碱土金属很容易与N2反应生成稳定的氮化物, 但碱金属与N2不直接反应。Ⅰ B和Ⅱ B的氮化物多数不稳定, 而Ⅲ A和Ⅲ B元素能形成稳定的共价化合物。Ⅵ B~Ⅷ 元素能形成隙间金属氮化合物。从Ⅳ A到Ⅷ 族元素对N2的亲和力逐渐减弱, 只有Fe、Co、Ni的氮化物只能与NH3反应生成, Fe2N、Fe4N均在(673~773) K下与NH3反应生成的。
在氨合成反应中有活性的催化剂介于Ⅳ B和Ⅷ 元素之间, 它们形成隙间金属氮化物。隙间金属氮化物由于氮掺入金属晶格而使得金属晶格扩展。因为表面原子比体相原子活泼, 所以化学吸附通常比与N2生成氮化物更容易。N2在室温下就可以化学吸附在蒸发形成的金属膜上。这些金属包括:Ⅱ A(Ca、Sr、Ba), Ⅳ B(Ti、Zr、Hf), Ⅴ B(V、Nb、Ta), Ⅵ B(Cr、Mo、W), Ⅶ B(Re)和Ⅷ (Fe)。值得注意的是这些金属都介于Ⅳ B和Ⅷ 族元素之间, 能够形成隙间金属氮化物。Ⅱ A金属及其形成的金属氮化物是N2的同位素交换反应的良好催化剂。然而在N2-H2气氛中易生成氢化物, 对氨合成反应没有活性。
其他金属也可以发生N2的化学吸附, 但不能形成氮化物。它们对N2的化学吸附能力太低, 不足以活化N2。因为即使是活性很低的Cu, 如果用离子轰击表面活化后也能吸附N2, 但Cu的氮化物Cu3N不稳定。近来也有还原的碱氧化物促进的钴氧化物在室温下就能吸附N2。贵金属(Ru、Rh、Os和Ir)在碱金属作促进剂条件下室温也能化学吸附N2。
金属对N2化学吸附活性不高的另一个原因是金属-氮的键能不高。化学吸附热通常随着表面覆盖度的增加而降低。尽管在蒸汽沉积薄膜上的初始化学吸附热比粉末或负载金属的大得多, 但蒸汽沉积薄膜上的初始化学吸附热降低很快, 可能是由于晶格无序性大造成的。
N2在金属上初始化学吸附热可通过量热法、等比容法及动力学方法测得。无论采用何种方法, N2在铁表面上初始化学吸附热约(220± 20) kJ· mol-1, 而在金属W表面的初始化学吸附热的值则较为发散, 约(310~490) kJ· mol-1。N2在金属上初始化学吸附热也可以通过经验计算方法获得, 如将初始化学吸附热和氮化物生成热关联起来, 具体的关联方法可参考相关文献。值得注意的是N2在贵金属上初始化学吸附热均为负值, 这是由于N2键能与金属-N2键能之间的差别引起。若确实为负值, 则表明N2在贵金属上的化学吸附是非稳态的。
对于任何一个化学反应都可以表示为:
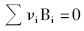
式中, ν i是组分Bi的化学计量系数; Bi是产物, ν i取正值; Bi是反应物, ν i取负值。然而上式没有在分子水平告诉化学反应式如何发生。所谓的基元步骤是一个或多个化学物种直接作用, 一步转化为反应产物的过程, 是组成化学反应的基本单元。
假设H2在相邻的两个空白活性位上进行解离吸附, 其基元步骤可写为:

而不能写为:
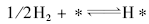
从机理上讲, 上式没有意义。
由N2和H2在Fe催化剂表面上合成氨, Ertl G等[30, 31]根据超高真空下的研究结果给出了如下催化循环:
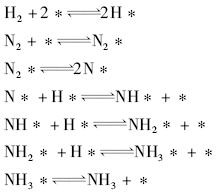
基于大量的对氨合成在Fe(111)晶面上基元步骤的详细研究结果, 图3-13给出了每个反应步骤的势能图以及非催化过程的势能图。在气相非催化反应中N2和H2的解离将需要非常高的能量。而在Fe(111)晶面存在下, 这个过程则克服非常低的能垒即可进行。化学吸附的N和H原子甚至具有多余的能量。后续N* 和H* 的结合以致NH3* 的脱附在高温的工业反应条件下能够很容易满足能量要求。
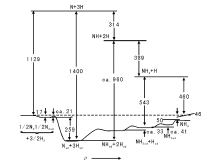 | 图 3-13 非催化和Fe(111)晶面上氨合成的热化学动力学势能示意图[31](单位:kJ· mol-1) |
Stoltze P[32]和Bowker M[33]均采用在超高真空条件下在铁单晶上的结果估算吸附和脱附速率常数, 而对于表面加氢则根据NHx* 物种的相对稳定性来近似。同时Bowker M研究组[33]使用工业氨合成反应器的动力学数据进行了进一步修正。基于氨合成反应的基元步骤和动力学数据, 他们构建了微观动力学模型, 并通过碰撞理论和过渡态理论估算了各基元步骤的速率常数、指前因子和活化能的数值。表3-1给出了用于微观动力学分析的基元步骤和建议的速率表达式及其估算值。模型Ⅰ 是Stoltze P和Norskov J K提出的, 而Bowker M等给出了模型Ⅱ 和Ⅲ 。两者机理相似, 唯一的区别在于Bowker M等让H2的解离通过一个前驱体。
| 表 3-1 氨合成机理和速率表达式 |
一个闭合的基元步骤序列定义为催化循环。将每个基元步骤的化学计量式左右两边分别加和就得到总包反应的化学计量式。假定某个基元步骤进行了σ 次, 则σ 就是该基元步骤的化学计量数。化学计量数由Horiuti首先提出。
虽然只有一个总包反应, 但它可以通过不同途径达到。对于含有多基元步骤的总包反应, 设想具有n个基元步骤的一个反应途径, 其中每一步的化学计量数为σ i。采用Temkin M I[35]提出的方法和准稳态近似法(总包反应的净速率等于每一步的正向速率与逆向速率之差), 再考虑化学计量数的因素, 就有: 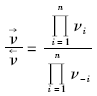
基元步骤的亲和势由De Donder公式表示:
如果在一个系列基元反应中, 存在一个速率决定步骤(rate determining step, 简写为rds, 反应速率最慢的基元步骤), 那么所有其他步骤处于平衡或准平衡状态, 即除i=d外, Ai=0, ν i=ν -i, 则:
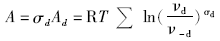
于是:
σ d=
总包反应A能从热力学数据看到, 只要知道
氨合成总包反应为:
N2 + 3H2=2NH3
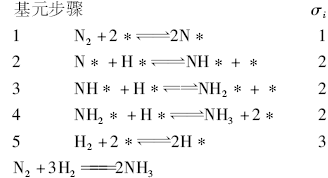
在高温下铁催化剂上比较一致的观点其催化循环表示为:
在低温下酶催化剂上的催化循环可以表示为:
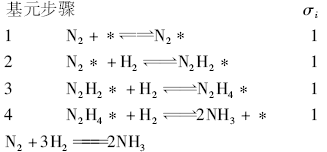
上述的催化循环可以简化为两步反应处理。假设反应远离反应平衡, 如此以致逆向速率可以忽略。根据速率决定步骤和最丰反应中间体(most abundant reaction intermediate, 简写为mari; 反应中间体中浓度远超过其他中间体的物种以致其他中间体的浓度可以忽略)不同, 氨合成反应可简化为如下几种两步反应:
(1) N2解离吸附为速率决定步骤, N* 为最丰反应中间体。
N2+2* → 2N*
(rds, 不可逆反应, 速率常数k1)
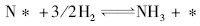
(非基元步骤, 平衡反应, 平衡常数K2)
则总速率可写为:
ν =k1[N2][* ]2[L]-1
其中, 总活性位数[L]=[* ]+[N* ], [* ]和[N* ]分别为空的或占有的活性位。
K2=[N* ][H2]3/2/([NH3][* ])
则[* ]=[L]/(1+K2[NH3]/[H2]3/2)
由此可得到总速率:
ν =[L]k1[N2]/(1+K2[NH3]/[H2]3/2)2
(2) N2解离吸附为速率决定步骤, NH* 为最丰反应中间体。
N2+2* → 2N*
(不可逆反应, 速率常数k1)
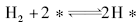
(可逆反应)
N* +H* → NH* +*
(不可逆反应)
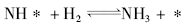
(非基元步骤, 平衡反应, 平衡常数K4)
则总速率可写为:
ν =k1[N2][* ]2[L]-1
[L]=[* ]+[N* ]
K4=[N* ][H2]/([NH3][* ])
于是可以得到:
[* ]=[L]/(1+K4[NH3]/[H2])
ν =[L]k1[N2]/(1+K4[NH3]/[H2])2
显然NH* 为最丰反应中间体或N* 为最丰反应中间体得到的总速率表达式十分接近。判定NH* 是否为最丰反应中间体, 可采用Tamaru的同位素突变技术[36]。
(3) N2缔合吸附为速率决定步骤, N2* 为最丰反应中间体。
N2+* → N2*
(rds, 不可逆反应, 速率常数k1)

(非基元步骤, 平衡反应, 平衡常数K2)
则有:
ν =k1[N2][* ]
[L]=[* ]+[N2* ]
K2=[N2* ][H2]3/([NH3]2[* ])
因此:
[* ]=[L]/(1+K2[NH3]2/[H2]3)
最后可得:
ν =[L]k1[N2]/(1+K2[NH3]2/[H2]3)
若根据动力学数据符合程度的情况来判别氨合成中是N2缔合吸附还是N2解离吸附机理很困难, 尚需进行其他实验。
氨分解反应是氨合成的逆反应, 早在20世纪30年代氨分解的动力学就已开始研究。研究发现Fe2N的分解比NH3和Fe形成氮化物要慢。在金属W上, 下面的速率方程很好的解释了实验结果:
ν =k
式中, k、k’ 、K和m(0< m< 1)均为常数。上述的速率表达式也适用于金属Mo, 甚至高温下的金属Fe、Pt以及Ru。从上式可以看出, 氨分解速率与氢气压力没有关系。在非常大的温度范围[(573~1 473) K]和压力范围[(0.133~1 333) Pa], 总速率表现出从低温时的零级到高温时的一级。上式速率方程也可以用经典速率表达式来描述:
ν =[L]k2K1[NH3]/(1+K1[NH3])
显然, 可以用如下的催化步骤解释:
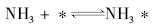
(非基元步骤, 平衡反应, 平衡常数K1)
NH3* → ……
(rds, 不可逆反应, 速率常数k2)
NH3* 为最丰反应中间体。然而实验结果显示, 在高温条件下, NH3* 的吸附非常弱; 解离的N* 、NH* 等较NH3* 更丰裕。因此, 如此的解释值得怀疑。
根据实验中发现的N从金属表面的脱附速率随N* 覆盖度的升高而加快, N的吸附速率随N* 覆盖度的升高而降低, 随
NH3+2* → NH2* +H*
(rds, 不可逆反应, 速率常数k1)
……
2N* → N2+2*
(rds, 不可逆反应, 速率常数k2)
则总速率可写为:
ν =ν 1-ν 2=k1[NH3][* ]2[L]-1-k2[N* ]2[L]
同时:
[N* ]/[* ]=([NH3]k1/k2)1/2
[L]=[* ]+[N* ]=[N* ](1+[* ]/[N* ])
于是可得到:
[N* ]=[L]([NH3]k1/k2)1/2/{1+([NH3]k1/k2)1/2}
然后可得到总速率:
ν =k2[L]([NH3]k1/k2)1/2/{1+([NH3]k1/k2)1/2}2
该速率方程与经典速率表达式非常相似。用以上反应物不可逆吸附和最丰反应中间体不可逆脱附所描述的机理很好的解释了Tamaru K[36]和Boudart M等[39]的数据, 他们的数据基于高温低压下在W和Mo上氨分解速率以及用俄歇电子能谱测定的N* 的表面浓度。用闪脱金属催化剂的方法扰乱其稳定态, 可以分别求出吸附和脱附不可逆步骤返回到稳定态的速率。
对于一组催化剂, 其中样品由大小为d的金属颗粒负载在惰性载体上构成。d值大小可以通过制备方法和负载量的变化进行调控, 得到(1~10) nm的金属颗粒。随着组成金属颗粒的原子数增加, 表面原子配位数和活性位相对浓度会发生变化, 这意味着表面结构变化了。当某一反应的转换速率随金属粒子大小d的改变而改变(图3-14), 则这一反应被称为结构敏感反应。
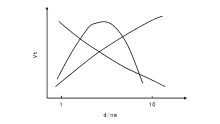 | 图 3-14 结构敏感反应的转换频率随金属颗粒大小的变化[34] |
当然, 证明转换速率的改变不是由载体效应等因素引起的非常必要。为排除载体效应等因素影响所导致的复杂性, 比较可靠的结构敏感性试验方法是在不同米勒指数的晶面上进行测试。表3-2为铁单晶不同晶面上氨合成的转化频率。铁单晶上的氨合成结果显示不同晶面上氨合成活性差别非常大, Fe(111)晶面氨合成活性最高, Fe(100)晶面次之, Fe(110)晶面几乎没有活性, 其相对活性比为418:25:1。
| 表 3-2 铁单晶不同晶面上氨合成的反应速率 |
Boudart M等[23]曾制备了氧化镁上负载的小颗粒金属铁, 其粒度为(1.5~30) nm。采用电子显微镜、X射线衍射、磁化率和穆斯堡尔谱等方法测定得到的颗粒大小与CO化学吸附(Fe/CO=2/1)的测量结果一致。氨合成的转换频率随金属铁颗粒大小的变化如表3-3所示。不同金属铁颗粒大小上的氨合成结果显示氨合成的转换速率随铁粒子大小增大而增加了35倍。转换速率随铁粒子大小变化的一个可能原因是金属-载体间的相互作用, 尤其在金属簇粒度较小时这种作用变得更强, 这一相互作用能够改变金属的电子结构, 从而影响催化剂活性。然而, 穆斯堡尔谱测量的金属铁结果显示在误差范围负载铁和体相铁结构相同, 排除了载体效应。基于单晶表面上的结果和负载型催化剂的结果可判定氨在铁催化剂上的合成是一个结构敏感反应。
| 表 3-3 氨合成的转换频率随金属铁颗粒大小的变化 |
当反应转换速率与金属粒子的大小或晶面无关时, 称这类反应是结构非敏感反应。对于某一给定的反应, 无论改变负载金属颗粒的大小还是改变晶面取向, 对转换频率均无影响。第一个证实的结构非敏感反应的例子是金属铂上的环丙烷氢解生成丙烷的反应。无论在负载的金属铂原子簇上还是大单晶上, 均显示反应的转换速率与金属粒子的大小或晶面无关。典型的结构非敏感反应例子有很多, 如CO在钯上的低压氧化反应、环己烯在铂上的加氢反应、氢氘交换反应等[34]。
非均匀表面的模型可以看成是由一群热力学和动力学性质相同的催化剂活性位组成的微区Ej构成。每个微区内, 表面是均匀的且单位面积含有dSj’ 个活性位。催化剂表面的活性位的分布是连续的, 因此, 活性位的密度[L]可以通过对所有微区进行积分求得:
Temkin方程式的第一个基本假设是催化剂表面的活性位存在如下连续分布函数:
dS’ =aexp(-γ Ao/RT )d(Ao/RT )
式中, dS’ 是微区Ej内单位表面上标准吸附势介于Ao和Ao+dAo之间的活性位数目; a为常数, 可以根据
第二个基本假设是反应速率ki与平衡常数Ki=ki/k-i之间遵从Brö nsted类型的关系:
ki=const×
式中, a是所谓的变换系数, 其数值在0和1之间, 通常约为0.5。该关系式是常见的动力学表达式。在酸碱催化作用和Polanyi-Semenov关系式中均能见到, 在物理有机化学中类似的关系式被称为线性自由能关系式。
第三个基本假设是两种化学上类似的步骤(如吸附和脱附)的Brö nsted变换系数a是相同的。总包反应的标准亲和势, 在某种意义上是一个常数, 与活性位本质无关。为了简化, 引入一个无量纲的亲和势t, 令t=Ao/RT, 并假定t有一个上限值t0和下限值t1。由此连续分布函数可写为:
则:
[L]/a=
a=[L]γ exp(γ t0)/[exp(γ t)-1]
用上式a值代入连续分布函数, 得到:
dS=dS’ /[L]
dS={γ exp(γ t0)/[exp(γ t)-1]}× exp(-γ t)dt
式中, dS是吸附亲和势介于t和t+dt之间的活性位分数。
第四个基本假设是关于辅助变量u0和u1的极限值的概念。所谓中等覆盖度是指当表面极不均匀时, 最活泼的吸附区域几乎完全充满, 最不活泼的吸附区域几乎完全空着。
辅助变量u的引入代替t是为了对计算积分, 令:
u=u0 exp(t0-t1)
显然u0是t=t0时的u值。假定在t=t0的上限值时, 所有的活性位都被占满, 则:
u0=[S1]/[S2]→ 0
式中, S1和S2分别表示空位和占有位。
u1是t=t1时的u值。假定在t=t1的下限值时, 所有的活性位都空的, 则:
u1=[S1]/[S2]→ ∞
通过积分, 得到的非均匀表面上反应速率表达式如下:
ν t=ν /[L]=τ {
τ =[π /sin(π m)]× {γ /[exp(γ t)-1]}
m=a-γ
和均匀表面上反应速率表达式存在类似之处。两个反应速率表达式中分数的分子是相同的, 分母含有相同的项, 但组合的方法不一样。
Temkin方程式首次应用于铁催化剂上的氨合成反应, 就得到了著名的Temkin-pyzhev反应速率方程式。氨合成总包反应方程式为:
N2+3H2=2NH3
假设N2的分子吸附为速率控制的两步机理, 可写成:
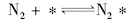
(rds, 不可逆反应, 正逆速率常数分别为k1和k-1)

(非基元步骤, 平衡反应, 平衡常数K2=k-2/k2)
其中N2* 为最丰反应中间体, N2的分子吸附为速率决定步骤, 因此:
假定[A1]≡ [N2], [A2]≡ [H2], [B2]≡ [NH3]以及[B1]≡ 1
应用到Temkin方程式得到:
ν t=τ {
根据以上的不等式, 可得到:
ν t=τ {
或者:
ν t=
用分压代入, 即得到:
ν t=k1
上述方程是Temkin和Pyzhev在1940年首先得出的, 而且至今一直以这种形式或与之类似的形式应用于氨合成反应器的设计中。
20世纪60年代, Temkin M I等[42]在推导中假设反应速率为两步, 第一步为氮的活化吸附, 第二步为氮的加氢, 即:
N2+* → N2*
(rds, 不可逆反应, 速率常数k1)
N2* +H2→ N2H2*
(rds, 不可逆反应, 平衡常数k2)
N2H4* +2H2→ 2NH3
(非基元步骤, 平衡反应, 平衡常数K3)
根据上述的两步反应, 推导出新的普遍化的动力学方程:
式中, l/
其后又有许多学者指出用分压计算反应速率整理出来的反应速率常数与压力有关。随着化学反应工程学的形成和完善, 人们不仅仅关心催化反应的微观机理, 而且更关心何种动力学模型及动力学参数更符合、关联和预示某种催化剂在工业反应器内的动力学行为。因此, 研究者又发展了宏观模拟-数学模型化的研究方法, 以解决反应工程上的需要。
Ozaki A等[43]试图通过在同一催化剂上比较氨合成反应速率来证明Temkin-Pyzhev方程所赖以建立的机理, 得出Temkin-Pyzhev方程预示了一个很容易被证明的结果:
Shapatina E I等[44]在铁催化剂上已经对此作了证实, 并得到m=0.5。这里m不是一个校正参数。在不用一个校正参数的情况下得到的计算值或实际值见表3-4, 理论值与计算值之间非常吻合, 而且在计算时没有采用任何近似。
| 表 3-4 Temkin-Pyzhev合成氨机理的验证 |
工业氨合成使用的熔铁催化剂是多孔性固体颗粒。活性中心分布在微孔的内表面上。还原后的氨合成铁催化剂, 其内表面积约(4~20) m2· g-1, 远大于颗粒的外表面积(仅约0.001 m2· g-1)。因此, 作为多孔催化剂上典型的气固相反应, 氨合成反应从反应物到产物要经历如下7个步骤:(1) H2和N2分子从气流中向熔铁催化剂的外表面扩散; (2) H2和N2分子从熔铁催化剂的外表面向内表面扩散; (3) H2和N2分子在熔铁催化剂内表面上解离吸附; (4) 解离吸附的H和N原子在熔铁催化剂表面化学反应; (5) 形成的NH3分子从熔铁催化剂内表面脱附; (6) NH3分子从熔铁催化剂的内表面扩散到外表面; (7) NH3分子从熔铁催化剂的外表面扩散到气流中。其中(1)和(7)为外扩散过程; (2)和(6)为内扩散过程, (3)、(4)和(5)为化学动力学过程。
之前所讨论的催化反应动力学均是消除了内扩散和外扩散影响的动力学, 即本征(微观)动力学。然而在工业催化剂上的化学反应不仅受催化剂上的本征动力学影响, 还受反应介质中的流动状态、传质和传热等影响。通常把考虑了传递过程温度和浓度梯度等影响的动力学称为宏观动力学。图3-15为球形催化剂颗粒周边和内部的温度与浓度分布。对于浓度梯度包括在颗粒与颗粒之间不充分的外扩散所引起的外扩散浓度梯度和颗粒内部不充分的内扩散所致的内扩散浓度梯度。对于温度梯度, 情况相似。
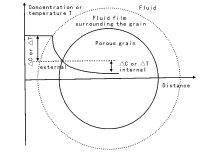 | 图 3-15 吸热反应中催化剂颗粒周边和内部的温度与浓度梯度 [34] |
外扩散影响可以通过如下两种方法进行判断和消除:(1) 保持相同的反应时间, 根据流体与催化剂颗粒之间的相对速率对转化率的影响进行判断。对于同一反应器, 随反应物流速的变化而增减催化剂用量, 从而保持相同的停留时间。若随反应物流速增大, 转化率趋于稳定值, 则外扩散已消除; (2) 在相同的实验条件下, 改变反应温度, 观察反应速率随温度的变化。若温度变化引起的反应速率变化不大, 且活化能小于20 kJ· mol-1, 则表明反应在外扩散控制区, 否则相反。
对于内扩散问题, 常采用的方法是检测不同粒径催化剂样品上的转化率。随粒径减少, 在相同反应条件下转化率上升至一极限值。在转化率极限值对应的催化剂粒径以下进行研究, 一般认为即可排除内扩散的影响。
对于气固相反应, 在稳定状态下单位时间内从气流主体扩散到催化剂外表面的反应组分i应该等于催化剂颗粒内实际的反应量:
rig=kgSg(cig-cis)=ksSsf(cis)ξ
式中, rig为组分i的宏观反应速率; kg为单位外表面积的扩散传质系数; ks为单位内表面积上的反应速率常数; Sg为单位体积催化剂床层中颗粒的外表面积; Ss为单位体积催化剂床层中颗粒的内表面积; cig为流体体相中组分i的浓度; cis为颗粒外表面上组分i的浓度; f(cis)为颗粒外表面到内表面组分i的浓度分布函数; ξ 为催化剂内表面利用率。
如果催化反应为一级可逆反应, 则浓度分布函数f(ci)=cig-
rig=(cig-
由宏观动力学表达式可以看出, 若催化剂颗粒内部保持不变, 当kg、Sg、ks、Ss、ξ 变化时, 反应可以处于动力学控制区、内扩散控制区和外扩散控制区。
(1) 本征动力学控制区
当1/(kgSg)≪1/(ksSsξ ), 且内表面利用率ξ 趋近于1时, 即内外扩散影响均可以忽略时, 则动力学表达式变为:
rig=ksSs(cig-
相应的浓度分布为:
cig≈ cis≈ cic, 而cic≫
式中, cic为颗粒中心处组分i的浓度。当外扩散传质系数kg相对较大, 而催化剂颗粒相当小时, 上述情况才可能发生, 得到的宏观动力学与本征动力学相同。
(2) 内扩散控制区
当1/(kgSg)≪1/(ksSsξ ), 且内表面利用率ξ 远小于1时, 即外扩散影响可以忽略时, 则cig≈ cis, 而内扩散对宏观反应速率具有重要影响。动力学表达式变为:
rig=ksSs(cig-
相应的浓度分布为:
cig≈ cis≫cic, 而cis≫
上述情况当外扩散传质系数kg相对较大, 而催化剂颗粒也相当大时才可能发生。
(3) 外扩散控制区
当1/(kgSg)≫1/(ksSsξ ), 即外扩散的影响成为主要阻力时, 动力学表达式变为:
rig=kgSg(cig-cis)=kgSg(cig-
相应的浓度分布为:
cig≫cis, 而cis≈ cic≈
上述情况一般发生在催化剂颗粒相当小、外扩散传质系数相对较小而反应速率常数相对较大时。如果所用的催化剂是无孔的网状物, 如氨氧化反应的Pt-Rh合金网, 或者活性组分只分布在颗粒外表面的薄层时, 也会发生上述情况。
对于熔铁催化剂上的氨合成反应, 空速通常在104 h-1数量级, 对于轴向流催化剂床层, 外扩散效应通常可以忽略; 而对于径向流催化剂床层, 由于气体流通面积增加, 外扩散效应予以考虑。无论是轴向流催化剂床层, 还是径向流催化剂床层, 内扩散影响都不容忽视[5]。
氨合成反应器(氨合成塔)是在高压和高温下用来使氮气和氢气发生催化反应以进行氨合成的设备。氨合成反应器在工艺上须满足氨合成反应尽可能在接近最适宜温度下进行, 以获得大生产能力和高氨合成收率, 要降低合成塔的压力降, 以减少循环
气体的动力消耗; 在结构上要求简单可靠, 并满足高温和高压的要求。
对于一定的氨含量, 氨合成反应速率最大时的温度称为最佳温度, 此最佳温度随着氨含量增大而降低。由于氨合成为放热反应, 催化剂床层的温度将随着反应进行而不断升高。为使氨合成反应能在接近最佳温度下进行, 需要采取措施移走多余的热量。工业上按照降温方式的不同, 将氨合成反应器分为冷管型、冷激型和中间换热型3类, 其原理图如图3-16所示。图3-17为典型的冷管型、冷激型和间接换热型氨合成反应器。
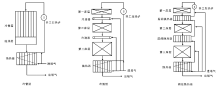 | 图 3-16 冷管型、冷激型和间接换热型氨合成反应器原理示意图[5] |
 | 图 3-17 典型的冷管型、冷激型和间接换热型氨合成反应器[2] |
(1)冷管型氨合成反应器。采用内置于催化剂床层中冷却管的方法, 以排除反应热并降低反应温度。冷却管既可冷却催化剂床层, 又可预热反应前的气体。冷管型反应器发展较早, 由于其压力降较大, 目前只用于中小型合成氨厂;
(2)冷激型氨合成反应器。采用反应前尚未预热的合成气进行层间冷激, 以降低反应气体的温度, 其优点在于结构简单可靠。由于冷激气体对反应气中氨的稀释, 较难获得高的氨净值。冷激型氨合成反应器设计的关键是如何使得冷激气与合成气均匀混合;
(3)间接换热型氨合成反应器。在绝热催化剂床层的层间安置中间换热器以预热未反应的合成气, 从而降低床层的反应温度。间接换热型氨合成反应器主要用于大型合成氨厂, 其结构相对复杂, 并开始在中小合成氨厂使用。
氨合成反应器可以仅用上述三种中的一种降温方式, 也可以将其中两种或三种方式结合起来应用。
3.6.1.1 Fe1-xO基催化剂
尽管研究者进行了广泛研究, 熔铁催化剂仍然是目前广泛应用的氨合成催化剂, 具有高活性, 使用寿命长, 密度高而且价格便宜。一般认为当熔铁催化剂前驱体是Fe3O4 时催化剂具有最高活性。因此在过去的熔铁催化剂研究中, 更注重助催化剂的调变和作用, 而忽视了催化剂前驱体的探索。刘化章等[5, 45, 46, 47, 48, 49]系统的研究了铁的3种氧化物(Fe3O4 , FeO和Fe2O3)及其混合物与催化活性的关系, 发现了具有维氏体结构的Fe1-xO基催化剂具有更高的活性, 它标志着熔铁催化剂的研究取得了实质性的进展。Fe1-xO基氨合成催化剂是目前世界上活性最高的熔铁氨合成催化剂, 并已在工业上得到广泛应用。
3.6.1.2 钌基催化剂
第一个有关钌基催化剂用于氨合成反应的研究报道可追溯到1917年, Bielawa H等[50]认为在氨合成反应中钌基催化剂的活性不如熔铁催化剂。直到1969年, Sudo M等[51]提出过渡金属电子授受型氨合成催化体系, 在温和条件下具有较高的氨合成催化活性, 钌基催化剂才重新引起人们重视。1972年, Aika K等[52]发现钌为活性组分、金属钾为促进剂、活性炭为载体的催化剂对氨合成有很高的活性。该发现激发了人们研究钌基氨合成催化剂的兴趣。由英国石油公司开发的以钌羰基化合物负载于含石墨炭载体上的Ru/C催化剂和以Kellogg负责开发与其配套的氨合成工艺, 经过10年的共同努力, 于1992年开发成功适用于Ru/C催化剂的KAAP新型氨合成工艺流程, 并实现了工业应用, 至今已有16家合成氨厂采用钌基催化剂[53, 54]。
钌基氨合成催化剂也被称为第二代氨合成催化剂, 主要特点是高活性、高的氨浓度、宽范围的H2/N2比且可用于低温和低压下操作。钌基催化剂为负载型金属催化剂, 其制备方法完全不同于传统的熔铁催化剂。通常采用浸渍法将钌和助剂化合物负载在载体上, 经一定条件还原活化后转化为活性组分即可。大量的研究表明, 钌的前驱体化合物、制备方法、载体、助催化剂及其相互作用对钌催化剂的性能有重要影响。
与铁基催化剂相同, N2在钌催化剂上解离吸附, 然后再加氢生成NH3是速率控制步骤。所不同的是在钌基催化剂上H2的吸附对N2的吸附有强烈的抑制作用, 而产物NH3的抑制作用并不明显。同时单晶、负载型催化剂、密度泛函计算结果均显示钌基催化剂上氨合成反应是典型的结构敏感反应。钌基氨合成催化剂的研究自20世纪70年代以来, 日本、德国、苏联、英国、美国、意大利和波兰等的学者以及我国浙江工业大学、福州大学、厦门大学、中国科学院大连化学物理研究所等进行了大量研究。
3.6.1.3 多金属催化剂
Mittasch A等[9]在氨合成催化剂探索的早期就认识到许多金属本身催化活性较低或根本没有催化活性, 然而添加某种金属后能显著提高它们的活性。Mittasch A在1930年就报道了Ni-Mo、Co-Mo、Fe-Mo对于氨合成具有很高的活性, 并且要求Mo的含量远高于Ni、Co、Fe的含量。
刘化章等[55]在高压条件下曾对Fe-Cu、Fe-Mn、Fe-Mo、Mg-Ni及Fe-Co等双金属合金催化剂进行了研究, 结果表明, Fe-Co双金属催化剂具有较高的活性, 在压力30 MPa、空速30 000 h-1、温度450 ℃时, 出口氨浓度达到26.25%, 较同样条件下A10型铁催化剂提高1%左右。试验中采用的Fe-Co催化剂是由磁铁矿和Co2O3、Al2O3、KNO3、CaCO3熔融制得。Fe-Co双金属催化剂中Al2O3含量小于3%活性最好, Co含量和比活性存在两个峰值分别约为15%Co和50%Co。
魏可镁等[56]研究发现铁催化剂中加入氧化钴在熔融过程中会与磁铁矿形成固溶体, 使离子半径较小的钴离子取代半径较大的铁离子, 降低了氧化态催化剂的晶胞参数。还原后金属Co原子进入α -Fe立方晶格, 使还原态催化剂晶胞参数变大, 显著提高了催化剂的活性; 魏可镁等制备的含Co的铁催化剂氨合成活性比未含钴的A101系列催化剂高5%~10%。
梁长海等[57]采用先浸渍RuCl3, 还原后再浸渍硝酸盐, 最后添加助剂的方法, 制备了Ru-Fe-Ba/C、Ru-Co-Ba/C和Ru-Mo-Ba/C催化剂。研究发现催化剂中添加Fe、Co和Mo会降低催化剂的活性, 但是各种金属的影响情况有所区别, Fe含量的增加会使活性下降是由于催化剂出现了表面富集Fe的Ru-Fe合金相。而Ru会促进Co的还原, 形成表面富集Ru的Ru-Co合金。少量Co的存在会覆盖Ru表面导致活性下降, 而大量添加Co则会掩盖Ru的活性, 因此随着Co的含量增加, 催化剂氨合成活性进一步下降。研究还发现Mo氧化物较难还原, 未完全还原的Mo覆盖了Ru的活性位并会与N2发生反应, 导致Ru-Mo体系的氨合成活性随着Mo的加入大幅下降。
大量研究显示氮在金属上的吸附能与金属催化剂的性能有一定的关系。Urabe K等[58]从氨的合成和分解中金属催化效率与氮的化学吸附能相关联得到一条火山形曲线, 其中催化活性较高的铁、钌、锇在火山曲线的顶端。Jacobsen C J H等[59]提出了通过理论计算设计合金催化剂具有与最活泼金属类似的对氮吸附能, 从而验证其合理性。结果发现钼氮化物催化剂的活性比Ru和Os更接近火山型曲线的顶点; 比单组分催化剂有更好的氨合成活性, 在低NH3浓度下比Fe和Ru还要好。
Kojima R等[60, 61, 62]系统的研究了钴钼双金属氮化物催化剂的合成氨性能, 结果如表3-5所示。
| 表 3-5 Co3Mo3N和Fe-K2O-Al2O3氨合成催化剂的性能比较 |
由实验结果可知, Co3Mo3N的确有较高的活性, 特别是2%碱金属Cs促进的Co3Mo3N-Cs2催化剂的比活性要比传统铁催化剂Fe-K2O-Al2O3高2倍以上。
如前所述, 合成氨工业经过一百多年的发展, 尽管基本工艺原理和生产工序没有多大改变, 但技术日趋完臻, 能耗已接近理论最小值。目前, 工业合成氨的原料和能源均来自于化石能源, 氨合成中的能耗大约30%用于动力消耗。因此降低现有合成氨工业的能耗, 必须寻找新的氨合成方法和途径。如果能将可再生的能源如太阳能、风能、水能、生物能或核能等直接或间接用于氨合成反应, 那将是合成氨工业的重大进展, 具有极其重大的理论和现实意义。
3.6.2.1 电催化氨合成
电催化氨合成可使热力学非自发反应, 如N2+3H2O=2NH3+1.5O2(K298=10-120)在电能的推动下发生反应, 并打破热力学限制的平衡。因此, 将电能引入合成氨过程辅助氮分子的活化或改变反应途径一直是备受关注的研究领域之一。电化学方法是一种可取的常压氨合成方法。例如在570 ℃和常压下, 使用氢气和氮气进行电化学氨合成, 其氢气转化率可接近100%[63]。因此, 近年来电化学常温、常压氨合成的研究也相当活跃。
在电化学氨合成中, 首先通过修饰电极表面的电催化剂对氮分子进行初步的吸附活化, 而后通过电极向被吸附的氮分子提供额外电子, 促使其进一步发生供电子活化并提供还原所需的电子, 同时通过电解质溶液或固体电解质向氮分子提供质子化所需的氢, 从而形成氨分子。电化学氨合成有利于创设与固氮酶相似的协同活化和还原合成的固氮环境, 且可以通过控制电极电势有效地控制氮分子的活化程度, 并通过控制氮气和质子的输送速率方便地控制合成过程。氨合成电催化剂主要包括负载铁酞菁催化剂的气体扩散电极、陶瓷固体电解质以及熔盐(LiCl/KCl/CsCl)等[64, 65]。采用室温下具有高质子导电性的固体电解质, 提高电流效率和电极稳定性是电化学合成氨未来研究的重要方向。
尽管目前电化学氨合成在经济上未必可行, 但对电化学氨合成的深入研究有助于开发新的氨合成途径, 如从水和空气直接合成氨。若电流效率和转化率能大幅度提高, 电化学氨合成在电能充足地区有望占有一席之地。同时随着化石能源的逐步枯竭, 传统的Haber-Bosch氨合成成本上涨是大势所趋, 电化学氨合成将具有潜在应用前景。
3.6.2.2 光催化氨合成
在常温常压下以水为氢源, 以太阳能为能源, 用光催化的方法使空气中的氮直接转化为氨的反应:N2+3H2O→ 2NH3+1.5O2, 则需要解决太阳能的输入方式和采用光催化剂。
近年来, 随着太阳能光化学研究的飞速发展, 光催化氨合成反应也取得较大进步。Schrauzer G N等[66]首先发现TiO2半导体粉末上用光催化还原氮的方法。Miyama H等[67]用掺入铂黑的TiO2、ZnO2、CdS、GaP半导体粉末和SiC的方法提高了氨的产率。李顺凤等[68]选择了Eg较小的WO3(Eg=2.7eV)为基质的多种光催化剂, 都获得了较高的氨产率, 相应结果见表3-6。
| 表 3-6 光催化剂的种类与氨产量的关系[68] |
3.6.2.3 化学模拟固氮酶仿生氨合成
自然界有一类固氮微生物, 其体内含有一种具有特殊本领的催化剂— — 固氮酶。它能在常温、常压的条件下将空气中的氮直接还原成氨。单位时间单位固氮酶还原的氮比目前工业熔铁催化剂氨合成的活性高出上千倍。据估计, 每年生物固氮的总量占地球上固氮总量的90%左右, 在地球的氮循环中具有十分重要的作用。生物固氮无论从其所需的条件, 还是固氮能力都超过了化学固氮。生物固氮可分为固氮菌固氮法和仿生化学固氮法[70, 71]。
固氮菌固氮法主要是通过生物工程, 在非豆科作物接种根瘤菌, 将固氮基因和其他相关基因或固氮生物引入非豆科作物, 实现自我供氮。随着转基因育种技术的发展, 实现非豆科作物接种根瘤菌自我供氮, 并大量种植豆科等油料作物(含氮7%~8%), 充分发挥油料作物根瘤菌共生固氮作用, 减少化学氮肥用量是解决农业生产中大量施用化肥所产生的负面影响的途径之一。
深刻理解生物固氮机理可以为化学模拟生物固氮提供重要的依据。大量的研究[70, 71]已证明生物固氮主要基于细胞体内两种含过渡金属的蛋白组分即Mo-Fe蛋白和Fe蛋白所组成的固氮酶体系, 再加上电子供体(生物还原剂)、电子传递体(如铁氧蛋白等)以及Mg-ATP等。生物固氮过程可以用下面的反应式表示:
N2+8H++8e-+16MgATP→ 2NH3+2H2+16MgADP+Pi
我国科学家也深入开展了生物固氮酶及其化学模拟研究工作, 并提出了由类立方烷结构的Fe2S2、Mo2O2八原子簇结构的一对偶联的二钼一铁三核活性中心模型, 用以阐明固氮酶各种底物的酶促还原反应机理[71]。Kim J等[72, 73]阐明了固氮酶的活性中心原子簇及其周围多肽分子的三维结构后, 化学模拟生物固氮的研究再次掀起热潮。
模拟生物固氮酶的功能制备出优良的催化剂实现常温、常压氨合成是人们追求的目标。化学模拟生物固氮的基本途径包括[5]:
(1) 模拟固氮酶的结构, 用Fe、Mo络合物作催化剂, 在强还原剂存在下, 以水为氢源, 得到了少量氨。由于固氮酶蛋白结构中含有Fe-Mo-S等元素, 并且在水相中固氮, 因此以水为介质的化学模拟生物固氮具有重要的意义;
(2) 非Fe、Mo过渡金属氮化的途径。金属化合物和还原剂组成的系统能不可逆的吸收氮, 然后将过渡金属氮化物水解而得到氨;
(3) 通过形成含氮分子过渡金属络合物, 然后还原得到氨。第一个含氮分子过渡金属络合物[Ru(NH3)5N2]2+(如下方程式)于1965年合成得到[74], 更加确信了模拟生物固氮酶的可行性。
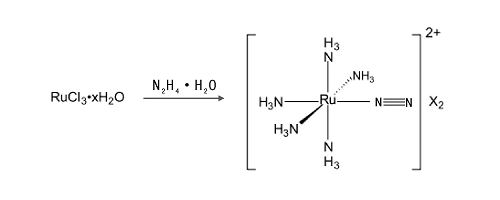
2003年, Schrock R R及其合作者[75, 76]研究开发了一种钼基催化剂, 能够通过质子和电子去还原N2得到NH3, 使用含有非常庞大的三酰胺-胺配体的钼氮络合物为催化剂。当采用CrCp* 2和2, 6-lutidinium][B(ArF)4在N2气氛下和上述钼催化剂作用, N2被还原成NH3且催化剂得以再生。为了达到高氮转化效率和最小化氢气的生成, 质子源和还原剂的缓慢添加非常必要。大量研究显示N2的还原发生在立体保护的单钼中心上, 在Mo(Ⅲ )、Mo(Ⅳ )、Mo(Ⅴ )和Mo(Ⅵ )上的循环如图3-18所示。
 | 图 3-18 [HIPTN3]Mo中心上通过质子和电子的逐步添加实现N2还原中间产物[75] |
Pool J A等[77]研究了直接使用氢气还原锆的氮分子络合物在低温、常压下合成氨, 如下所示:
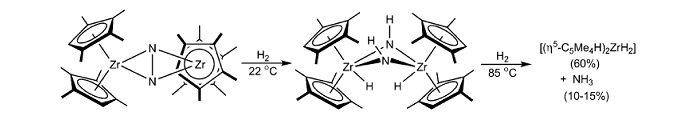
侧配位的氮分子络合物[(η 5-C5Me4H)2Zr]2(μ 2, η 2, η 2-N2)与H2在室温下反应形成桥式diazenido络合物[(η 5-C5Me4H)2ZrH]2(μ 2, η 2, η 2-N2H2 )。桥式diazenido络合物进一步在相对高温下与氢气反应生成单锆二氢化物和低收率的氨气。
尽管N2的活化在前过渡金属化合物上取得重要进展[78, 79, 80], 但是人们仍然在铁基络合物上进行了探索, 并取得重要进展[81]。如曲景平等[82]最近设计合成了一类新型邻苯二硫酚桥联双核铁配合物, 建立了双铁分子仿生化学固氮新的功能分子模型。通过实验化学、分析测试表征并结合理论计算等系统研究, 实现了在双铁中心上二氮烯还原转化成氨的全过程, 揭示了氮气在固氮酶铁钼辅基(FeMo-cofactor)金属簇[Fe7MoS9X, X=C, N或S]的“ 腰部” 双铁中心上活化转化的本质, 提出了HN=NH→ HN— NH2→ NH(+NH3) → NH2→ NH3仿生固氮新机理。
催化氨合成技术在20世纪化学工业的发展中起着核心的作用。氨合成催化剂和反应是多相催化领域中许多基础研究的起点和试金石, 是将理论计算、模型催化剂、实验技术和工程结合起来成功研究的典范。合成氨工业经过百年的发展, 技术日趋完臻, 但耗能依然巨大, 约占全球耗能总量的1%~2%。而自然界中存在的生物固氮酶能够在常温、常压下将氮气转化成氨。因此, 室温和常压下氮的活化和氨合成仍是科学领域最具挑战性的课题之一。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|