作者简介:单 鑫,1984年生,男,山东省单县人,硕士,工程师,研究方向为橡胶助剂清洁生产。
硫化促进剂DM是一种应用广泛的橡胶硫化促进剂,工业化生产方法主要为亚硝酸钠法。目前行业普遍采用的化学反应方程式存化学计量比与实际不符、反应物的角色不明确及化学反应类型不明晰。提出两种最可能的多相催化氧化反应机理,即亚硝酸催化机理和二氧化氮(或一氧化氮)催化机理。工业生产中存在的催化效应衰减现象由氧化过程中排空造成的氮氧化合物大量损耗和发生较多的副反应引起。
DM is widely used as the rubber vulcanization accelerator,which is mostly produced by sodium nitrite method.There existed three unscientific points in widespread accepted reaction equation.Two heterogeneous catalytic oxidation mechanisms which were most possible for the synthesis reaction,namely catalytic mechanism of nitrous acid and nitrogen dioxide(or nitric oxide) catalytic mechanism were put forward.The reason for and influence of the catalytic effect decreasing phenomenon were discussed,and it was concluded that the catalytic effect decreasing phenomenon of commercial production was caused by more side reaction and the loss of a large amount of nitrogen oxide due to emptying during oxidation process.
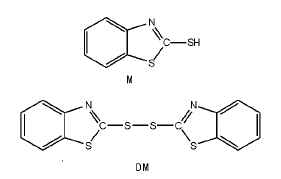
硫化促进剂DM为淡黄色晶体, 微毒, 无臭, 略有苦味, 是目前应用广泛的通用型噻唑类促进剂, 也是一种非常重要的药物合成中间体。作为天然胶、合成胶和再生胶通用型硫化促进剂, 一般温度下可使橡胶快速硫化, 硫化曲线较为平坦, DM本身在胶料中易分散, 不污染, 其硫化临界温度较高(130 ℃), 温度高于140 ℃时活性增强, 有显著的后效性, 操作安全。硫化胶物理机械性能和耐老化性能优良, 除不适用于与食物接触的橡胶制品外, 可用于制造轮胎、胶管、胶鞋和胶布等一般橡胶工业品, 工业应用市场稳定[1]。
硫化促进剂DM的生产工艺主要为精制后的硫化促进剂M即2-巯基苯并噻唑与氧化剂反应制得DM, 所用氧化剂主要有亚硝酸钠、氯气、次氯酸钠、过氧化氢和氧气等[2, 3]。
硫化促进剂 M(RSH)和 DM(RSSR)的结构式为:
以氯气和次氯酸钠为氧化剂, 对人体和环境危害严重, 产生的含盐有机废水处理难度大, 工艺安全性差, 已逐步淘汰。以过氧化氢为氧化剂, 虽具有三废排放少和基本无污染的优点, 但工艺不成熟, 离工业化生产还有一定距离。以氧气为氧化剂, 虽然具有反应速率快、辅助材料少、收率和纯度较高及环境友好等优点, 但氧气易燃、易爆, 技术安全难度大, 对设备要求较高, 应用有限。亚硝酸钠法是传统的生产工艺, 工业应用广泛, 工艺路线相对成熟, 安全性和成本控制上具有明显优点, 产品质量稳定。
本文目的在于揭示催化氧化反应机理的本质和催化效应衰减的特点, 并通过分析催化效应衰减的原因及造成的影响, 为DM的绿色清洁生产提供理论支撑和工业改进启发。
亚硝酸钠法合成DM的反应过程为:在原料M和亚硝酸钠浆料中滴加稀硫酸, 通入空气, 一定温度下发生氧化反应生成DM。目前行业中普遍采用的总反应方程式为[1]:
2RSH+H2SO4+2NaNO2
作者认为, 用这一方程式描述该反应存在以下问题:
(1) 化学计量比与实际不符。从反应方程式看, 原料M和亚硝酸钠物质的量比为1∶ 1, 但实际生产中约为7∶ 1。两者相差巨大, 方程式无法正确描述该反应。
(2) 反应物的角色不明确。空气中的氧气如何参与反应?与其他原料的反应计量比如何?生成的一氧化氮怎样进一步参与反应?这些关键信息从反应方程式本身均无法体现。
(3) 化学反应类型不明晰。从反应方程式看, 这只是一个普通的氧化还原反应, 而化学计量比与实际不符这一现象明确指出实际反应过程并没有这么简单, 那么真实的反应究竟如何发生?反应类型如何?方程式没有给出答案。
显然, 用这一方程式描述该反应不够科学和严谨, 不能真实体现化学反应本质, 对科学研究和工业应用有一定的误导作用。事实上, 行业中对于这一传统生产工艺的合成机理缺乏深入研究。
经过查阅借鉴书籍和文献[4, 5]资料, 结合科研以及生产实际, 作者认为最有可能的反应机理有亚硝酸催化氧化机理和二氧化氮(或一氧化氮)催化氧化机理。
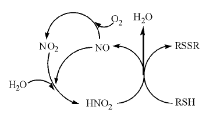
亚硝酸催化氧化机理见图1, 其反应历程如下:
2NaNO2+H2SO4→ Na2SO4+2HNO2 (1)
2RSH+2HNO2→ RSSR+2NO+2H2O (2)
2NO+O2→ 2NO2 (3)
NO+NO2+H2O
第一步:亚硝酸钠与滴加的稀硫酸反应, 生成亚硝酸; 第二步:生成的亚硝酸立即与浆料中的M接触反应, 并将后者的硫醇基氧化成双硫键, 生成目标产物DM, 亚硝酸则被还原为一氧化氮气体; 第三步:一氧化氮分子与鼓风进来的空气中的氧气分子结合, 很容易被氧化成二氧化氮气体; 第四步:一氧化氮、二氧化氮与溶剂水反应, 生成亚硝酸, 后者又进一步氧化M, 如此循环。由于亚硝酸本身极不稳定, 不能在该条件下单独存在, 只有立即与原料M发生有效接触的亚硝酸能够参与第二步反应, 其余生成的亚硝酸则快速发生歧化分解, 生成一氧化氮、二氧化氮和水, 因此, 第四步反应为可逆反应。
第二、第三和第四步合并后的总方程式为:
4RSH+O2
从式(5)和图1可以看出, 这是一个亚硝酸催化和氧气氧化M生成DM的反应, 亚硝酸在其中扮演了化学催化剂的重要角色。
氧气本身是弱氧化剂, 无法在一般条件下单独氧化M生成DM, 而亚硝酸中的氮处于中间价态, 既具有氧化性又具有还原性, 而且氧化性比还原性突出, 实际上其氧化性强于稀硝酸, 这是因为3价氮比5价氮更不稳定, 极易捕获电子, 稀硝酸的电极电位为0.957 V, 亚硝酸的电极电位为0.99 V[6]。亚硝酸在参与氧化反应的同时, 自身被还原为一氧化氮, 后者又与氧气和水结合, 重新生成亚硝酸。所以, 通过亚硝酸的参与, M分子与氧气分子之间电子的传递更加容易, 拉低了整个反应的过渡态势能, 使氧化反应能够比较容易发生, 亚硝酸本身则在反应前后保持不变, 体现出催化剂特点。
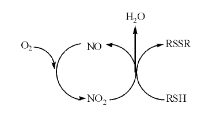
二氧化氮(或一氧化氮)催化机理见图2, 反应历程如下:
2NaNO2+H2SO4 
2HNO2 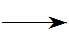
2RSH+NO2 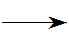
2NO+O2 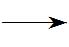
第一步与亚硝酸催化氧化机理相同; 第二步:亚硝酸不稳定, 很容易发生歧化分解, 生成一氧化氮、二氧化氮和水; 第三步:二氧化氮与M接触, 氧化生成DM, 自身被还原为一氧化氮; 第四步:一氧化氮与鼓风空气中的氧反应, 重新生成二氧化氮, 后者再次氧化M, 如此循环。如果将式(8)和式(9)互换位置, 也可同样解释为一氧化氮催化氧化M生成DM。
第三和第四步合并后的总方程式:
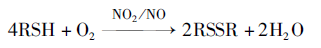
由式(10)及图2可以看出, 与机理一类似, 这也是一个化学催化氧化反应, 不同的是催化剂由亚硝酸变为二氧化氮(或一氧化氮), 通过催化剂的参与, 使M分子与氧气分子之间电子的传递更容易, 有利于氧化反应的进行, 而二氧化氮(或一氧化氮)本身则在反应前后保持不变, 体现出催化剂的特点。
虽然这两种反应机理不尽相同, 但本质上可归纳为:
4RSH+O2
其中, 催化剂为亚硝酸或其分解产生的二氧化氮(或一氧化氮), 溶剂在这里是水。实际上可以理解为, 这两种催化机理同时存在、同时发生, 亚硝酸和二氧化氮只要能与M分子进行有效接触, 均可能发生氧化反应。以上描述的是无副反应发生的理想情况, 实际情况比这复杂。
式(11)体现一般情况下的催化反应特点, 即催化剂在理论上没有消耗, 只是参与了化学反应的过程。但工业生产远不是这种理想情况, 实际上, 大约每7 mol的M参与反应, 就会损耗约1 mol的催化剂, 导致催化效率极大衰减, 以致于很多时候难以理解其催化氧化本质。造成这一现象的主要原因有:(1) 氧化过程中排空造成的氮氧化合物大量损耗; (2) 有较多的副反应。
这些副反应分为两大类, 一类是氮元素的损耗, 使催化剂数量快速减少, 如:
2NO2+H2O→ HNO2+HNO3
另一类是氧化的竞争反应, 即硝化反应, 结果造成原料M和催化剂同时损耗, 如:
RSH+N2O3→ RSNO+HNO2 (13)
硝化反应影响主反应的产品收率, 这种影响随着溶液pH值的减小逐渐增大, pH值低至一定程度时, 其反应速率甚至会远大于氧化反应速率, 所以工业生产中对氧化pH值的控制非常关键。
总体来说, 不论是物理排空还是化学副反应, 不仅极大影响化学反应本身的催化效率, 而且给工业生产带来诸多难题:
(1) 对环境的影响。氧化排空会排放较多的氮氧化合物, 造成大气污染; 副反应产生的盐类和硝化产物最终变为固废, 处理困难; 催化效应衰减迫使生产上使用更多的亚硝酸钠和硫酸补充其损耗, 导致更多的含盐废水和氮氧化合物的排放, 使整个生产过程对环境产生较大危害。
(2) 对成本的影响。催化效应衰减使原料消耗大幅度增加, 反应时间变长, 设备动力和能耗增大, 浪费资源, 生产成本增加。
传统的DM生产方法亚硝酸钠法由于污染难处理和工艺流程相对落后, 研究者试图用其他生产工艺取代, 但新工艺仍没有很好地实现工业化。而恰恰相反, 正是因为亚硝酸钠法是非常成熟的生产方法, 往往将其视为即将被淘汰的落后工艺, 不愿再研究, 但事实上, 对其认识并非面面俱到, 有许多细节没有被揭示出来, 实现DM的清洁化和自动化生产的关键因素有可能隐藏在这一合成反应本身。
通过对反应机理的深入探讨, 揭示了亚硝酸钠法合成DM的多相催化氧化本质, 且该催化反应在目前工艺条件下具有催化效应衰减的现象, 这种催化效应的衰减给工业生产带来诸多不利影响。
如何一方面合理利用催化反应的性质, 另一方面有效抑制催化效应衰减, 实际上给工业生产提出一个启发性问题, 也使该研究具有深刻的现实指导意义和应用价值。如果能够很好的解决这一问题, 在提高生产效率和降低生产成本的同时, 也将使DM的生产过程具备清洁化和连续化的特点, 符合可持续发展的要求。
(1) 提出亚硝酸钠法生产硫化促进剂DM的多相催化氧化反应机理。亚硝酸钠与硫酸反应生成的亚硝酸或其分解生成的二氧化氮与M分子发生有效接触, 后者氧化为DM, 亚硝酸或二氧化氮则被还原成一氧化氮, 一氧化氮又被空气中的氧气氧化为二氧化氮或继续与水反应生成亚硝酸, 如此循环反应。该反应体现出催化反应的特点, 其中, 催化剂为亚硝酸或其分解产生的二氧化氮和一氧化氮。
(2) 分析了实际生产中的催化效应衰减及其产生的原因和造成的影响。实际工业生产中, 大约每7 mol的M发生反应, 消耗约1 mol催化剂, 该反应的催化效率受到很大影响, 产生催化效率衰减的原因主要有:(1) 氧化过程中的物理排空, 排放了大量的氮氧化合物; (2) 硝化等副反应导致催化剂和M的损失。催化效应衰减很大程度造成环保压力大, 生产成本高。
(3) 对工业改进提出启发。作为传统生产方法, 亚硝酸钠法生产DM具有很多优点, 但同时也存在污染难治理和连续化程度低等缺点。如果工业生产中能够更加合理利用这一化学反应的多相催化氧化机理, 同时有效抑制催化效应衰减造成的催化剂损失, 就有可能从根本上改进工艺过程, 实现清洁化和连续化生产。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|