作者简介:马 幸,1990年生,女,河北省新乐市人,在读硕士研究生。
采用浸渍法制备不同PdCl2含量的贵金属催化剂,并对反应前后催化剂进行傅里叶红外和物理结构表征。结果表明,PdCl2质量分数为3%的催化剂活性最高,可在70 ℃实现低浓度CO的完全转化。反应后,催化剂表面没有明显变化,催化剂比表面积增大,孔容及平均孔径呈减小趋势。研究进口CO浓度和空速对CO转化率的影响,结果表明,在一定浓度范围,提高进口CO浓度对CO转化率没有影响,浓度超过1 000×10-6时,CO转化率下降;空速升高,CO转化率下降,温度越低,空速对CO转化率影响越大。
The noble metal catalysts with different PdCl2 contents were prepared by impregnation method.The catalysts before and after reaction were characterized by FTIR and N2 physical adsorption.The results of activity measurement revealed that the catalyst with 3wt% PdCl2 had the highest activity and could achieve the total conversion of low concentration CO at 70 ℃.No change of the surface of the catalyst after reaction was observed according to the results of IR characterization.The results of N2 physical adsorption revealed that the specific surface area of the catalysts increased,and the pore volume and the mean pore size showed the trend of decrease.The influence of inlet CO concentration and GHSV on CO conversion was investigated.The results indicated that within certain concentration,the increase of inlet CO concentration had no influence on CO conversion; whereas CO concentration exceeded 1 000×10-6 or the GHSV was increased,CO conversion decreased.The lower the temperature,the greater the effects of space velocity on CO conversion.
CO催化氧化用催化剂主要分为贵金属催化剂和金属氧化物催化剂。金属氧化物催化剂价格低廉, 催化活性高, 受到普遍关注。Co3O4是催化活性较好的氧化物催化剂, 可在-80 ℃时实现低浓度CO的完全氧化[1]。CuO[2]、CeO2[3]和Fe2O3[4]等也对CO的氧化有良好的催化活性。此外, 二元金属氧化物催化剂如CuO-CeO2[5]、CuO-MnOx[6]、CuO-Fe2O3[7]等也可以实现低温条件下CO的完全转化。但金属氧化物催化剂容易受气体湿度的影响而失活, 催化稳定性难以保证, 限制了此类催化剂的实际应用[5]。与金属氧化物催化剂相比, 尽管贵金属催化剂价格相对较高, 但低温催化活性以及催化稳定性较好, 其中, 纳米Au催化剂最受关注, 普遍认为, Au是一种惰性金属, 几乎不参与化学反应, 但Haruta M等[8]发现, 负载Au催化剂可以在接近室温条件下有效催化CO的氧化反应。此后, 对Au催化剂催化氧化CO的机理作了研究, 结果表明, 在CO催化氧化过程中, OH基团具有十分重要的作用[9], 但制备方法对此类催化剂活性影响较大, 重现性较差, 并不适于实际工程中CO的催化氧化。而铂族金属(Pt、Pd、Ru等)对CO的催化氧化则较为稳定, 研究最多的是Pd催化剂[10, 11, 12]。
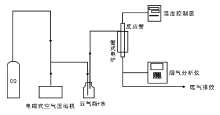
密闭空间或半密闭空间中CO对人的健康产生严重影响, 此类烟气的特点为:(1) CO浓度比较低, 低于2 000× 10-6, O2浓度较高; (2) 温度较低, 一般不超过100 ℃。尽管有相关研究就水对催化剂催化活性进行了研究, 但水浓度较低(小于0.6%), 不符合实际应用情况。本文将水浓度提高至约3%(室温下饱和水蒸汽), 此条件下, 研究Pd/Al2O3催化剂活性及稳定性, 并对反应前后催化剂进行红外表征, 对比反应前后催化剂的表面性质, 分析催化剂活性下降的原因, 考察Pd含量、CO浓度和反应空速对催化剂催化活性的影响。
PdCl2, 分析纯; 盐酸36%38%, 分析纯; CO, 8%, 钢瓶气, 北京市海瑞通达气体有限公司; γ -Al2O3, 江苏连连化学股份有限公司, 比表面积为196 m2· g-1, 平均孔容0.84 cm3· g-1, 平均孔径14.5 nm, 平均粒径7.793 μ m。
KQ2200E型超声波清洗器, 昆山市超声仪器有限公司; JJ-1精密定时电动搅拌器, 江苏省金坛市荣华仪器制造有限公司; S49-32B/MT型质量流量控制器、MT51-2J型流量显示仪, 北京汇博隆仪器有限公司; D07-7B型质量流量控制器、D08-1F型流量显示仪, 北京七星华创电子股份有限公司; 电磁式空气压缩机, 浙江森森实业有限公司; CKW-1100型温度控制器, 北京市朝阳自动化仪表厂。
实验中CO浓度由德国德图公司testo 350M测定, 检测精度05 000× 10-6, 误差范围≤ ± 1%。
美国麦克仪器公司LS I3 320型粉尘粒径分布仪; 傅里叶红外光谱分析仪; ASAP2050物理吸附仪, 比表面积由BET方程计算, 孔容、孔径由BJH方程计算。
采用浸渍法制备催化剂, 催化剂活性组分含量以PdCl2计。用0.1 mol· L-1的盐酸将PdCl2溶解形成PdCl2含量为10 g· L-1的溶液。取一定量的PdCl2溶液, 加水稀释至50 mL, 加入载体γ -Al2O3后, 用磁力搅拌器搅拌2 h, 105 ℃烘干, 550 ℃焙烧3 h, 即得到PdCl2质量分数分别为1.0%、1.5%、2.0%、2.5%、3.0%的Pd/Al2O3催化剂。焙烧后的催化剂研磨, 用标准检验筛筛分, 取(2040)目催化剂用于催化剂活性测试。
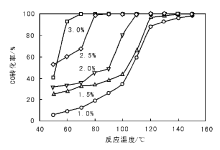
在CO浓度1 200× 10-6和空速9 000 h-1的条件下, 考察不同PdCl2含量对CO转化率的影响, 结果如图2所示。由图2可以看出, 除1.0%Pd/Al2O3催化剂外, 其他催化剂在150 ℃时的CO转化率均为100%。随着PdCl2含量增高, 催化剂活性升高, 3.0%Pd/Al2O3催化剂活性最高, 可在70 ℃实现CO的完全氧化。而2.5%、2.0%和1.5%的Pd/Al2O3催化剂分别在90 ℃、120 ℃和150 ℃时实现CO完全氧化。普遍的观点是贵金属催化剂对CO的氧化遵从Langmuir-Hinswood机理[13], 即反应过程中CO和O2均在金属表面吸附, 然后吸附态的CO和O2发生反应, 反应速率取决于CO解离。在此反应过程中, CO吸附严重影响O2吸附。Pd负载量较低时, CO和O2不能充分吸附在催化剂表面被活化发生反应。随着反应温度升高, 催化剂活性升高, 这是因为高温条件促进了CO解离。
表1为反应前后催化剂的微观结构。
| 表 1 反应前后催化剂微观结构 Table 1 The micro-structure of the fresh and used catalysts |
从表1可以看出, 反应后, 2%Pd/Al2O3催化剂比表面积不变, 3%Pd/Al2O3催化剂比表面积减小, 其余催化剂比表面积均增加; 3%Pd/Al2O3催化剂孔容增加, 1.5%Pd/Al2O3催化剂孔容保持不变, 其余催化剂的孔容均减小。由此可知, 催化剂比表面积的大小不是决定催化剂活性的必要条件, 催化剂活性随Pd负载量的增加而升高。在催化反应过程中, 孔道变化极其复杂, 平均孔径的不规律变化印证了这一点。催化剂孔道堵塞引起催化剂孔容减小。
在催化剂物理结构表征中, 2.5%Pd/Al2O3催化剂的孔容和孔径变化最为明显。为观察反应前后催化剂的结构变化, 对反应前后的2.5%Pd/Al2O3催化剂进行红外表征, 结果如图3所示。测试条件:CO浓度1 200× 10-6, 空速9 000 h-1, 100 ℃下测试20 h, 测试过程中CO转化率为100%。
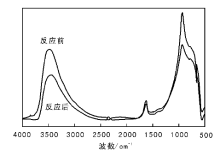 | 图 3 2.5%Pd/Al2O3催化剂反应前后的红外光谱图Figure 3 FTIR spectra of 2.5%Pd/Al2O3catalysts before and after reaction |
(1 7002 200) cm-1处对应CO化学吸附峰[14], 从图3可以看出, 在此区间内没有明显的峰值, 可能是因为反应过程中CO完全转化为CO2, 或者CO吸附量很小。尽管反应体系中有水存在, 催化剂反应前后也未产生明显变化。
在空速9 000 h-1条件下, 考察3.0%Pd/Al2O3催化剂上进口CO浓度对CO转化率的影响, 结果见图4。
由图4可见, 反应温度较低时, 进口CO浓度对CO 转化率的影响较大, 进口CO浓度为1 500× 10-6时, 50 ℃时的CO转化率仅为14.1%, 这可能是由于活性位较少, CO和O2发生了竞争吸附, CO吸附阻碍了O2吸附活化, 致使反应速率降低。反应温度超过90 ℃时, CO转化率均为100%。
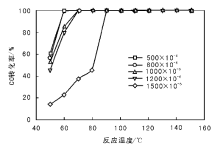
在CO进口浓度1 200× 10-6条件下, 考察空速对CO转化率的影响, 结果见图5。由图5可见, 提高空速, CO转化率下降, CO完全转化的温度升高, 2.5%Pd/Al2O3催化剂升高约20 ℃, 3.0%Pd/Al2O3催化剂升高约30 ℃。根据Langmuir-Hinswood机理, 空速提高时, CO和O2与催化剂的接触时间变短, 不能与活性位点充分接触, 从而使催化剂活性下降。2.5%Pd/Al2O3催化剂在空速9 000 h-1和80 ℃时的CO转化率为99.08%, 3.0%Pd/Al2O3催化剂在空速18 000 h-1和80 ℃时的CO转化率为53.67%, 而在反应温度高于90 ℃时, CO转化率几乎相同, 表明空速和反应温度均对催化剂产生影响。反应温度越低时, 空速的影响越大。
(1) 催化剂的催化活性随Pd负载量的增加而升高, 3.0%Pd/Al2O3催化剂活性最高, 可在70 ℃时实现较低浓度CO的完全转化。
(2) 对反应前后物理结构变化明显的2.5%Pd/Al2O3催化剂进行了红外表征, 结果显示, 反应后催化剂没有明显的变化, 这可能是因为反应时间较短, 催化剂表面变化不明显。
(3) 进口CO浓度、反应温度和空速均会影响CO转化率。相同温度下, 增大进口CO浓度或提高空速, 催化剂效率降低。低温条件下, 空速和浓度对催化剂效率影响较大。因此, 今后研究的重点应是提高催化剂在高空速时的低温活性。应综合CO浓度、空速和反应温度等操作条件对催化剂进行深入研究, 确定催化剂的最佳使用条件。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|