作者简介:周立坤,1982年生,男,博士,工程师,研究方向为固体催化剂及工艺开发。
以硝酸镍和偏钨酸铵为前驱体,活性炭(AC)为载体,通过等体积浸渍氢气还原法分别制备Ni-W2C/AC和Ni/AC催化剂,利用 N2吸附仪、XRD、TEM、TG和XRF等对催化剂及原料进行表征。釜式反应器中,对催化剂催化果糖或果糖基能源植物菊芋根茎制备多元醇高附加值化合物进行评价。结果表明,相同反应温度下,与间歇进料方式相比,泵注入方式能进一步提高1,2-丙二醇和乙二醇收率。以果糖为底物,泵速0.5 mL·min-1条件下,氢气起始压力4.0 MPa、温度245 ℃时,1,2-丙二醇和乙二醇收率分别为41.4%和18.7%,二者总收率较间歇进料增加17.9个百分点;以菊芋根茎为底物,氢气起始压力3.5 MPa、温度255 ℃时,1,2-丙二醇和乙二醇收率分别为37.7%和27.4%,二者总收率较间歇进料增加10.7个百分点。结合果糖、葡萄糖分子在氢气气氛下进行的逆羟醛缩合和加氢过程,分析泵注入进料提高1,2-丙二醇和乙二醇收率的主要原因。
Using nickel nitrate and ammonium metatungstate as the precursors and active carbon(AC) as the support,Ni-W2C/AC and Ni/AC catalysts were prepared respectively by incipient-wetness impregnation and hydrogen reduction method.The raw material of JAT and catalysts were characterized by N2-physisorption,XRD,TEM,TG and XRF.A series of tests of catalytic hydrogenation of fructose or fructose-based energy plant Jerusalem artichoke rhizomes(JAR) to some high value-added polyols were implemented to evaluate the difference between the pump injection and intermittent feeding ways in the tank reactor.The results showed that pump injection feeding way could effectively improve the yields of 1,2-propanediol(1,2-PD) and ethanediol(ED),compared with the intermittent feeding mode at the same reaction temperature.The yields of 1,2-PD and ED were 41.4% and 18.7% from fructose under the condition of initial H2 pressure 4.0 MPa,temperature 245 ℃,feed rate 0.5 mL·min-1,and 4%Ni-20%W2C/AC catalyst,and the total yield increased by 17.9 percentage point.The yields of 1,2-PD and ED were 37.7% and 27.4%,respectively,under the condition as follows:initial H2 pressure 3.5 MPa and temperature 255 ℃ and JAR as the substrate,and the total yield of two polyols increased by 10.7 percentage point,compared with that of intermittent feeding way.The reasons for improving the yields of 1,2-PD and ED by pump injection feeding mode were also analyzed in combination with the retro-aldol and hydrogenation processes of fructose and glucose under the hydrogen atmosphere.
依赖化石能源的工业生产过程, 面临着严峻的资源枯竭和严重的环境污染问题[1, 2]。因此, 基于可再生资源开发具有持续、高效、稳定、清洁的工业生产新路线已引起广泛关注[3, 4]。生物质是自然界中唯一一种可提供有机碳源的可再生资源, 生物质资源储量丰富, 是替代传统能源的理想原料[1, 4]。
木质纤维素的转化是生物质利用的主要途径之一[5, 6, 7]。菊糖是构成生物质的一种多糖化合物[8], 主要由果糖单体组成, 分子末端链接一个葡萄糖单体。菊芋根茎是富含菊糖的天然载体[8, 9], 由于人体缺少消化菊糖的菊糖酶, 因此, 菊芋根茎不会像淀粉载体类植物一样成为人类的主要食物来源[10], 而菊芋秸秆可用于制备乙二醇等化学品[11]。菊芋是用于工业填料的理想能源植物。
果糖分子含有不饱和的酮基官能团, 通过雷尼Ni[12]或Ru[13]催化剂作用加氢可制备糖醇。近年来, 果糖、菊芋根茎被用于开发制备生物乙醇[14, 15]、1, 2-丙二醇和乙二醇等多元醇[16, 17, 18]化学品。生物乙醇可直接利用或作为平台化合物使用[19], 1, 2-丙二醇和乙二醇都是重要的化工产品, 被广泛用于生产聚酯纤维、不饱和聚酯树脂和冷冻剂等产品[20]。由于菊芋根茎在作为底物进行的催化转化过程中只需简单的物理处理, 因此以天然生物质菊芋根茎为工业填料的生产过程是一条潜在的绿色工艺途径。
本文以硝酸镍和偏钨酸铵为前驱体, 活性炭(AC)为载体, 通过等体积浸渍氢气还原法分别制备Ni-W2C/AC和Ni/AC催化剂, 利用 N2吸附仪、XRD、TEM、TG和XRF等对催化剂及原料进行表征。在釜式反应器中, 采取泵注入方式进料, 对催化剂催化果糖或果糖基能源植物菊芋根茎制备多元醇高附加值化合物进行评价。
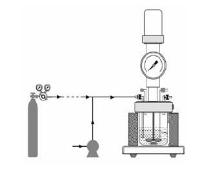
实验装置如图1所示, 主要由进料进气组件和釜式反应器组成。其中, 反应釜为Parr 5500高压釜, 容积100 mL。在反应达到指定温度时, 反应料液通过泵注入至反应釜中。
将菊芋根茎洗净切片于60 ℃烘箱中烘干, 研磨筛取< 60目干基粉末。取菊芋根茎干粉40 g, 按固液比1:15的比例加入600 mL去离子水搅拌溶解, 90 ℃热水中水浴20 min。冷却后过滤, 滤饼在相同条件下重复水提两次。合并三次滤液定容至2 000 mL, 得到含有菊糖、果糖、葡萄糖及其他水溶成分的菊芋根茎水溶液。
利用液相色谱通过外标法定量分析其中的单糖、多糖及总糖含量。首先, 对配置的菊芋根茎水溶液直接分析, 确定果糖和葡萄糖含量; 其次, 取5 mL菊芋根茎水溶液, 经过硫酸完全水解以及氢氧化钠中和后, 定容至100 mL。取样分析, 确定其中的总糖(果糖和葡萄糖之和)含量; 最后, 利用总糖含量减去水解前溶液中的单糖含量即得到菊糖含量。相应地可分别计算各糖的碳含量。
菊芋根茎中元素种类及含量通过X射线荧光光谱分析, 灰分含量通过热重-差热分析仪测量。
载体来源于NORIT公司商品化活性炭, 使用前需要预先进行酸洗处理, 具体操作见文献[21]。活性炭50 g置于500 mL圆底烧瓶中, 加入125 mL质量分数65%的浓硝酸和125 mL去离子水, 于80 ℃回流水浴24 h。结束后冷却至室温, 用80 ℃去离子水反复洗涤至中性, 120 ℃烘箱中烘干, 获得的活性炭作为催化剂载体使用, 记为AC。
催化剂采用等体积浸渍氢气还原法制备(以10%Ni/AC-773K为例)。取1.12 g六水合硝酸镍加水溶解, 将溶液浸渍到2 g的AC, 依次于60 ℃和120 ℃下烘12 h, 得到催化剂前驱体。再于石英管中, 按照每克载体对应60 mL· min-1氢气流速, 于500 ℃温度下还原1 h。结束后冷却至室温, 在20 mL· min-1的1%O2-N2气氛下钝化吹扫6 h, 获得10%Ni/AC催化剂。利用相同的方法制备催化剂4%Ni-20%W2C/AC, 还原温度为700 ℃[22]。
催化剂评价实验操作以果糖为底物进行的反应为例:反应前, 取0.3 g催化剂置于反应釜中, 并加入25 mL去离子水。密封反应釜接通氢气置换6次后充填至4 MPa, 关闭阀门。利用程序升温组件加热反应釜, 达到反应温度255 ℃后, 通过泵以1.0 mL· min-1的泵速将20 mg· mL-1果糖水溶液泵入反应釜, 直至泵入25 mL, 开始计时, 反应30 min后停止。待反应釜温度降至室温时, 取反应液利用针筒式水膜(Φ 13 mm× 0.45 μ m)过滤并于高效液相色谱进行分析。
当反应底物为菊芋根茎溶液时操作同上述描述。液相产物同样通过液相色谱分析、定量, 分析条件同对菊芋根茎水溶液糖含量的测定方法。
高效液相色谱分析仪, 美国Agilent公司1200系列, 色谱柱采用Shodex公司的SC1011型钙离子交换糖柱, 检测器为RI示差折光检测器; 流动相为超纯水, 流速0.6 mL· min-1, 柱温45 ℃, 分析时间40 min。物理吸附仪, ASAP 2010型, 美国麦克仪器公司。化学吸附仪, AutoChem 2920型, 美国麦克仪器公司。X射线衍射仪, X'pert ProSuper型, 荷兰PANalytical公司, CuKα , λ =0.154 32 nm, 镍滤波, 石墨单色器, 工作电压40 kV, 工作电流40 mA, 扫描范围10° ~90° , 扫描速率12.5° · min-1。透射电子显微镜, Tecnai G2 Spirit 120 kV, 美国FEI公司。X射线荧光光谱仪, Axios型, 荷兰PANalytical公司, X射线发生器功率2.4 kW。热重-差热分析仪, Setsys 16/18型, 法国Setaram公司。
菊芋根茎中菊糖含量及产物中多元醇收率Y分别由式(1)和式(2)计算:
式中, mI为菊糖质量; mT为总糖质量; mF为果糖质量; mG为葡萄糖质量; MCOP为产物多元醇中碳的摩尔数; MCOF为反应底物中碳的摩尔数。
根据实验结果, 菊糖及单糖总含量为73.5%, 热重法测定的灰分主要包括无机盐类矿物质等[42], 含量为2.2%。其他组分主要包括粗纤维、木质素、原蛋白和氨基酸等化合物。
对菊芋根茎粉末进行XRF测定, 结果显示ω (C)=43.68%, ω (H)=6.11%, ω (O)=48.82%, ω (K)=0.99%, ω (Ba)=0.08%, ω (Ca)=0.05%, ω (Mg)=0.05%, ω (Fe)=0.01%, ω (Cl)=0.13%, ω (S)=0.04%, ω (Si)=0.02%。菊芋根茎属于天然生物质, 因此含有多种金属及非金属元素。构成糖类的C、H、O为其主要元素组成, 此外还含有K、Ba、Ca、Mg、Cl等元素。碱金属和氯元素在生物质中普遍含量较高[23]。
催化剂及载体的物化性质和活性组分含量如表1所示。从表1可以看出, 载体AC的比表面积为764 m2· g-1, 孔体积为0.54 cm3· g-1。负载活性组分Ni和W后制备得到的催化剂4%Ni-20%W2C/AC, 比表面降至312 m2· g-1, 孔体积降至0.42 cm3· g-1。催化剂10%Ni/AC比表面积未有较大变化, 而孔体积增加。此外, 与载体AC相比, 负载活性组分后, 催化剂的微孔比表面积及微孔体积都明显降低, 原因是催化剂在还原过程中, Ni对AC的甲烷化引起[24, 25], 因此, 平均孔径也明显增加。通过XRF分析, 4%Ni-20%W2C/AC催化剂中活性组分Ni和W的实际负载质量分数分别为10.9%和50.3%, 10%Ni/AC催化剂中Ni的实际负载质量分数为12.4%。经氢气还原后得到的催化剂Ni和W的实际含量较理论负载量增加较多, 原因也是Ni对AC的甲烷化引起。
| 表 1 催化剂及载体的物化性质和活性组分含量 Table 1 Physicochemical properties of AC, 10%Ni/AC and 4%Ni-20%W2C/AC catalysts, and active component contents of Ni and W |
催化剂与载体的N2吸附-脱附等温曲线和部分孔径区域的孔径分布如图2所示。从图2可以看出, 在相对压力大于0.45时, 载体及催化剂的N2吸附-脱附等温曲线中有回滞环出现, 表明介孔的存在。但没有明显的饱和吸附平台, 说明孔结构很不规整。在相对压力较高区域的闭合点反映孔吸附特性, 其中, 载体AC和10%Ni/AC催化剂在高相对压力区域吸附曲线升高缓慢, 趋于吸附饱和。根据IUPAC分类, 这两种回滞环属于H4型, 说明载体和催化剂为微孔和中孔混合型。催化剂4%Ni-20%W2C/AC的吸附量在较高相对压力区间内随相对压力的升高而迅速增大, 说明N2的吸附未达到饱和状态, 催化剂的回滞环属于H3型, 反映的孔情况类似于平板狭缝等结构。从图2还可以看出, 与载体AC相比, 10%Ni/AC催化剂中Ni还原过程引起AC的甲烷化过程改变了载体的孔分布, 小于20 nm的孔道数量明显增加。在(3~15) nm有一个明显峰出现, 说明较均匀的孔径多分布于这一区域中。而对于4%Ni-20%W2C/AC催化剂, 可能由于负载的活性组分含量较高, 致使催化剂总孔体积及比表面积数量减少。
 | 图 2 AC载体和10%Ni/AC、4%Ni-20%W2C/AC催化剂的N2吸附-脱附等温线和孔径分布曲线Figure 2 N2 adsorption-desorption isotherms and pore size distribution curves of AC, 10%Ni/AC and 4%Ni-20%W2C/AC catalysts |
催化剂和载体的XRD如图3所示。从图3可以看出, 载体AC为非结晶无定型体, 未有明显衍射峰, 在26.7° 出现的峰对应为石墨碳。10%Ni/AC催化剂在44.5° 、51.9° 和76.4° 为镍单质晶相衍射峰, 说明催化剂活性组分Ni已被很好地还原。4%Ni-20%W2C/AC催化剂除形成明显的W2C晶相外, 也有镍钨合金生成(2θ =43.8o为Ni17W3)。此外, 对于负载活性组分的两种催化剂, 石墨碳的衍射峰强度降低, 可能原因是催化剂还原过程中, Ni催化AC生成甲烷造成的[24, 25]。
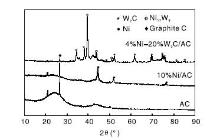 | 图 3 载体AC和10%Ni/AC、4%Ni-20%W2C/AC催化剂的XRD图Figure 3 XRD patterns of AC, 10%Ni/AC and 4%Ni-20%W2C/AC catalysts |
10%Ni/AC和4%Ni-20%W2C/AC催化剂的TEM照片如图4所示。从图4可以看出, 10%Ni/AC催化剂活性组分Ni粒子尺寸比较均一, 并且均匀分散于载体AC上。4%Ni-20%W2C/AC催化剂活性组分在催化剂表面明显凝聚成团, 而且团聚体含量占催化剂比重较大, 这与物理吸附和XRF测量结果相一致。催化剂中Ni的存在能较大的促进催化剂催化菊芋根茎制备1, 2-丙二醇和乙二醇等多元醇的能力, 而且Ni和W的理论负载质量分数分别为4%和20%时活性最好[16]。然而Ni的存在又使催化剂在还原制备过程中引起AC的甲烷化, 不仅造成载体的大量损耗, 又造成活性组分的聚结, 以及降低催化剂的比表面积和分散度。Ni的加入对催化剂制备及物性兼具积极和消极的作用。
釜式反应器间歇加料情况下, 在反应温度245 ℃、氢气起始压力6 MPa和反应时间80 min条件下, 由菊芋根茎为底物, 可得到38.5%的1, 2-丙二醇, 1, 2-丙二醇和乙二醇总收率为52.6%。1, 2-丙二醇收率随果糖浓度的增加而减少[16]。原因是, (1)果糖直接加氢制备六元醇的反应温度较逆羟醛缩合反应再加氢生成1, 2-丙二醇的低, 前者反应更容易进行[13, 16]。当果糖浓度高时, 更多的果糖分子生成六元醇[16]; (2)果糖发生逆羟醛缩合反应生成1, 3-二羟基丙酮和甘油醛[16], 1, 3-二羟基丙酮进一步加氢生成1, 2-丙二醇。混合不同质量比的两种中间物种的加氢反应表明, 低浓度1, 3-二羟基丙酮情况下, 甘油醛异构生成1, 3-二羟基丙酮现象明显[16]。降低果糖浓度时, 有助于提高1, 3-二羟基丙酮生成, 1, 2-丙二醇含量增加; (3)反应过程中底物果糖、产物多元醇也会发生聚合、降解等副反应[26], 降低了果糖转化率及1, 2-丙二醇收率, 果糖浓度的提高增加了副反应的发生。
半连续进料葡萄糖溶液至釜式反应器中, 在偏钨酸铵和Ru/AC催化剂作用下的加氢研究中[27], 当底物葡萄糖溶液浓度为10%, 泵速率由10 mL· min-1降至2 mL· min-1时, 主产物乙二醇收率由17.7%增至50.2%, 这说明进料速率对乙二醇含量影响较大。作者认为, 葡萄糖生成乙二醇过程中, 中间物种乙醇醛发生了直接加氢生成乙二醇的主反应以及其他副反应, 主副反应对于底物浓度分别为一级和二级动力学关系。因此, 底物浓度的变化对副反应影响更加明显, 为使反应向主反应方向进行, 可通过降低底物浓度实现, 而泵注入方式进行的半连续进料能达到降低底物浓度的效果。
釜式反应器中, 泵注入方式进料催化果糖或菊芋根茎制备多元醇的反应结果如表2所示。从表2可以看出, 反应温度245 ℃时, 4%Ni-20%W2C/AC催化剂作用下, 1, 2-丙二醇和乙二醇收率分别为36.4%和5.8%。当使用泵注入方式进料果糖溶液, 进料结束反应30 min后, 1, 2-丙二醇和乙二醇收率分别达到41.4%和18.7%, 较间歇进料增加17.9个百分点。可见泵注入进料方式能有效提高1, 2-丙二醇和乙二醇收率, 并有效抑制副产物丙三醇的生成, 由23.1%降至9.7%。原因是降低果糖浓度时, 逆羟醛缩合反应生成的1, 3-二羟基丙酮浓度降低, 另一逆羟醛缩合产物甘油醛向1, 3-二羟基丙酮异构的比例增加, 从而使甘油醛加氢后生成的丙三醇产率降低[16]。羟基丙酮是果糖生成1, 2-丙二醇过程中一种较稳定的中间物[16], 泵进料时, 羟基丙酮收率由5.2%降至2.0%, 因此更多的羟基丙酮加氢生成1, 2-丙二醇。此外, 泵进料情况下, 除甘露醇和山梨醇收率略有减少外, 赤藓糖醇和1, 2-丁二醇收率没有明显变化。提升反应温度至255 ℃, 泵速由0.5 mL· min-1增至1.0 mL· min-1时, 1, 2-丙二醇以及乙二醇收率基本保持不变, 但丙三醇收率显著提高, 此时六元醇收率降低。
以菊芋根茎为底物时, 常规间歇进料, 反应温度255 ℃时, 1, 2-丙二醇和乙二醇收率各为41.8%和12.6%, 二者总收率54.4%。而采用泵注入方式进料时, 1, 2-丙二醇收率为37.7%, 乙二醇收率为27.4%, 二者总和达到65.1%, 较间歇进料方式增加10.7个百分点。泵注入方式进料与常规进料相比, 1, 2-丙二醇和乙二醇收率增减趋势发生了反向变化。Kovalenko利用生物多相催化剂A.nicotianae, 在碱性条件下(pH=7.8)对葡萄糖、果糖混合液异构生成果糖的反应进行了研究[28], 结果表明, 异构化反应的初始速率随着果糖浓度的升高而增加。在本研究体系中, 降低果糖浓度时, 果糖可能向葡萄糖异构转化, 进而葡萄糖经过逆羟醛缩合及加氢反应后会生成更多的乙二醇。
以菊芋根茎为底物, 泵注入方式进料时, 1, 2-丙二醇收率减少的更明显。原因是, 一方面, 由于菊芋根茎和菊糖中含有一定量的葡萄糖单体, 葡萄糖加氢主要生成乙二醇[5, 6]。菊芋根茎还含有其他非碳水化合物, 因此相同质量的菊芋根茎和果糖作为底物时, 前者的果糖含量较低。另一方面, 反应过程中一部分果糖异构为葡萄糖, 同样降低了可转化为1, 2-丙二醇的果糖含量。
Ni/AC催化剂在催化果糖及菊芋根茎反应中同样表现出较好的活性及选择性, 反应条件下, 不仅具有很好的加氢活性, 同时也表现出对C— C键的逆羟醛缩合作用[16]。对不同Ni负载量的Ni/AC催化剂的活性考察实验, 较Ni-W2C/AC相比, 前者六元醇收率高, 也说明W物种对C— C键逆羟醛缩合的促进作用[5]。提高Ni的理论负载量由10%至20%过程中, 目标产物1, 2-丙二醇收率略有降低, 由32.9%降至29.5%。乙二醇收率基本不变。相同条件下, 丙三醇、六元醇等多元醇收率随催化剂Ni含量的改变也未有明显变化。当底物为菊芋根茎时, 1, 2-丙二醇和乙二醇收率较Ni-W2C/AC催化剂作用相比降低, 对应六元醇收率升高。
| 表 2 不同催化剂催化果糖和菊芋根茎制备多元醇 Table 2 Products distribution for fructose or JAT transformation over different catalysts |
在Ni-W2C/AC或Ni/AC催化剂及相同反应温度下, 以果糖或果糖基能源植物菊芋根茎为底物, 泵注入进料方式能明显提高目标产物1, 2-丙二醇和乙二醇收率。分别以果糖和菊芋根茎为底物时, 二者总收率可达到60.1%和65.1%, 与普通间歇进料方式相比, 分别提高了17.9百分点和10.7百分点。泵注入进料方式提高总收率的原因是降低果糖瞬时反应浓度时, (1)抑制果糖直接加氢生成六元醇反应的发生; (2)提高果糖经逆羟醛缩合生成的甘油醛向1, 3-二羟基丙酮异构趋势, 有利于1, 2-丙二醇前体的生成; (3)降低果糖和多元醇产物聚合、降解等副反应的发生。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|