作者简介:李霖,1988年生,男,陕西省咸阳市人,研究方向为催化及环保新材料。
金是一种高化学惰性金属,其纳米粒子具有独特的结构和性质,在催化、光电传感器和生物医药等领域应用广泛。研究表明,负载在金属氧化物等载体上的纳米金粒子具有很高的催化活性,特别是在CO低温催化氧化中,催化效率明显高于其他类型贵金属。纳米金催化剂的研究已经具有了相当的深度和广度,在工业催化和环境保护等领域显现出重要的发展前景和商机。
Gold has high chemical inertness and gold nanoparticles with unique structure and property have been used in catalysis,photoelectric sensor,biological medicine,and many other fields.Many studies have shown that gold nanoparticles have high catalytic activity when loaded onto metal oxides or other carriers,especially in catalytic oxidation of CO at low temperature in which gold nanoparticles have higher catalytic efficiency than other precious metals.Nanometer gold catalysts have been studied deeply and widely.And nanometer gold catalysts show important development prospects and opportunities in industrial catalysis,environmental protection and other fields.
金是一种高化学惰性金属, 其纳米粒子具有独特的结构和性质, 在催化、光电传感器和生物医药等领域应用广泛。纳米金最早出现在16世纪, 瑞士医生Paracelsus用“ 饮用金” 医治精神类疾病。从1857年Faraday通过还原氯化金得到含纳米金溶液, 一直到1971年Faulk和Taylor首次开创了纳米金免疫标记技术[1, 2]。虽然纳米金技术的发展历经了很长时间并且取得研究成果, 但纳米金催化剂起步相对较晚。
金催化剂的发展始于20世纪80年代, Haruta M等[3]首先发现负载在过渡金属氧化物上的纳米金粒子具有较高的催化活性, 特别是在CO低温催化氧化中。负载型纳米金催化剂具有独特优点[4]:(1) 催化活性较高, 反应条件较为温和; (2) 是一种软L酸, 与π 体系具有很好的亲合性, 可以用于催化一些特别的反应; (3) 通常是一种绿色环保催化剂。本文综述负载型纳米金催化剂的研究进展。
负载型纳米金催化剂制备方法包括沉积-沉淀法、原位法、溶胶-凝胶法、化学气相沉积法、浸渍法和共沉淀法等。浸渍法是最常用的方法之一, 一般微孔材料作载体的负载型纳米金催化剂多采用沉积-沉淀法和浸渍法制备, 而Fe2O3作载体的金催化剂多采用共沉淀法制备。
沉积-沉淀法的关键在于pH的控制, 由于形成的纳米金粒子分布较为均匀, 粒径相对较小, 得到的纳米金催化剂性能较为出色。Uphade B S等[5]制得的催化剂中纳米金粒子很均匀地分布在载体Ti-MCM上, 并且粒径很小。该课题组[6]还报道了一种性能出色的用于丙烯气相环氧化反应的纳米金催化剂, 载体为新型介孔材料TUD-1。
沉积-沉淀法存在一定局限性, 当载体等电点(IEP)小于5时, 不能进行金纳米粒子的负载, 如等电点为2的二氧化硅。一般采用等电点为6~9的金属氧化物作为载体, 如等电点为8~9的三氧化二铝。由于制备多采用碱性物质作沉淀剂, 可能会在一定程度上影响载体的孔结构和性能, 如分子筛HMS和SBA-15。Song H Y等[7]报道了在以尿素为沉淀剂制备Au/Ti-HMS催化剂时, 因载体的孔结构遭到破坏, 催化活性下降。
原位法又叫一步法, 适用于该方法的载体大多是具有特殊结构的介孔材料, 金源是被引入载体内与模板剂结合, 然后自发进行孔壁自组装, 因此金和载体界面结合强度较高, 高温焙烧除去模板剂得到纳米金催化剂。这种方法的优点在于金纳米粒子的负载与介孔材料的孔壁自组装是一步完成, 工艺过程较为简单, 不会出现像沉积-沉淀法因碱性使载体孔结构被破坏, 从而导致催化性能下降的现象。不过高温焙烧去除模板剂的同时也会造成金的团聚和烧结, 从而导致催化剂性能在不同程度上的降低。
Chatterjee M等[8]将一种新型的超临界CO2技术引入到纳米金催化剂制备中, 采用原位法, 以介孔MCM-48为载体, 制得的纳米金粒径小而均匀。Lee B等[9]将保护剂引入纳米金催化剂制备过程中, 以三羟甲基丙烷三丙烯酸酯为保护剂, 以介孔HMS为载体, 用萃取法替代焙烧法去除模板剂, 制得分散性高且粒径小的纳米金粒子。
溶胶-凝胶法也是制备负载型催化剂常用方法之一, 是将金前驱体与载体预先混合均匀, 通过水解和缩合在溶液中形成透明溶胶, 经过陈化形成凝胶, 再经过干燥和焙烧得到纳米金催化剂。该方法的优点在于工艺较为简单, 焙烧时金的烧结不明显, 适用的载体有二氧化硅、三氧化二铝和二氧化钛等, 这是由于这些金属氧化物可由对应的本体溶胶硅溶胶、铝溶胶和钛溶胶得到。不足之处主要在于金负载量低。Seker E等[10]通过溶胶-凝胶法制备了负载型纳米金催化剂, 以具有较大孔径分布的三氧化二铝为载体, 对溶胶-凝胶形成过程中金纳米粒子的粒径变化趋势进行了研究。
化学气相沉积法是以惰性气体为载气, 将挥发性有机金组分导入到载体表面, 经充分接触再焙烧, 即可得到成品催化剂。化学气相沉积法是惟一能够在任意一种载体上负载金纳米粒子的方法, 能够制备粒径分布较窄的高分散纳米金粒子, 并且不会影响载体的孔结构。虽然该法从理论上是非常简单易行的一种方法, 但是在工艺上却比其他方法复杂, 对设备的要求也较高, 而且有机金源具有较高毒性, 使化学气相沉积法在应用上存在一定局限性。Okumura M等[11]通过化学气相沉积法法制备了两种纳米金催化剂, 以MCM-41和活性炭为载体, 制得的纳米金粒子平均粒径小于2 nm, 且分布均匀。
负载型纳米金催化剂制备方法对比见表1。
| 表1 负载型纳米金催化剂制备方法对比 Table 1 Comparison of preparation method of supported nanometer gold catalyst |
选择载体时一般需要参考载体的比表面积、孔容和孔径、润湿性以及载体与金之间的相互作用力。比表面积是评价载体性质最常用的物理参数, 比表面积越大, 金纳米粒子在载体表面的负载量和分散度也越大。孔容和孔径可以表征孔道的通畅程度, 孔容和孔径越大, 越有利于金纳米粒子均匀分布在载体的孔道和内表面上[12]。载体润湿性是指载体能被溶剂润湿的性质, 对于高温焙烧过程中金纳米粒子是否会团聚有一定的影响作用。载体与金之间的相互作用力是决定负载型纳米金催化剂性能的重要因素, 相互作用强度越高, 金原子的流动性越低, 高温焙烧过程中金纳米粒子不易因烧结而导致减活。
Masatake H A等[13]对纳米金粒子在载体表面的形态进行了描述, 认为载体与金之间的相互作用力是影响纳米金粒子形态的重要参数之一, 当作用力较强时, 金纳米粒子是以半球状吸附在载体表面, 而该作用力较弱时则为球状吸附, 对于前者来说金纳米粒子的自由能大于后者, 因此更容易吸附反应介质, 制得的纳米金催化剂性能一般也优于后者。
金纳米粒子最佳粒径通常为(2~3) nm, 而粒径超过10 nm时, 纳米金催化剂性能会快速降低[14]。表面和界面效应和量子尺寸效应是影响纳米金催化剂活性的两个因素, 表面和界面效应表现在随着金纳米粒子粒径的减小, 其比表面积相应增加, 更多的原子会处于表面状态, 更大的表面使纳米金粒子表面自由能、剩余键力和粗糙度均有所增加, 继而出现很多的活性中心, 使催化活性大大提高。金纳米粒子的量子尺寸效应是由Lai X等[15]通过密度泛函理论计算得出, 认为纳米级金会由准连续的金属状态变成一系列独立的分散状态, 从而具备较高的催化活性。
载体比表面积小于100 m2· g-1时, 纳米金粒子粒径大小可由金负载量控制, 且负载量与粒径大小成正比关系。Mavrikakis M等[16]用大比表面积的硅气溶胶作为载体, 在金负载量相对较大情况下, 制得粒径小于5 nm的金纳米粒子。
3.1.1 CO低温催化氧化
CO低温催化氧化是负载型纳米金催化剂最重要的应用之一, 已在尾气催化燃烧和室内空气净化方面体现出较高的实用价值, 并有望应用于CO防毒面罩、CO气体传感器及封闭内循环式CO2激光器等新的技术领域。
纳米金催化剂在低温下能够催化氧化CO最早是在1977年由Huber H等[19]发现。Haruta M等[20]以三氧化二铁为载体, 用共沉淀法制备出负载型纳米金催化剂, 该催化剂在203 K时对CO的催化氧化表现出较高活性, 在约273 K即可完全消除CO。除三氧化二铁外, 适用于CO低温催化氧化体系的载体主要以金属氧化物和分子筛类为主。该反应对水汽不敏感, 即使在高湿度的常温环境中也能够连续数天催化氧化CO不衰减。
3.1.2 丙烯环氧化
环氧丙烷是除聚丙烯和丙烯腈之外, 丙烯的第三大衍生物, 在工业上有着多种重要的用途。目前国内大多采用氯醇法制备环氧丙烷, 该法除了工艺复杂外, 最主要的是环保问题。负载型纳米金催化剂是绿色催化剂, 可以用于烯烃催化氧化反应。Haruta M等[21]最早利用负载型纳米金催化剂在有H2情况下将丙烯氧化为环氧丙烷。Lu J Q等[22]以Ti-TUD为载体, 制备了含Ba纳米金催化剂, 对丙烯进行了选择性环氧化反应, 催化剂活性与纳米金粒径成反比, 选择性非常高。
3.1.3 醇、醛选择性氧化
醇选择性氧化是合成羰基化合物或相关衍生物的重要途径, 这些羰基化合物或羰基衍生物常用作医药或农药的中间体使用。文献[23, 24]报道了关于醇和多元醇选择性催化氧化方面的基础性研究。Christensen C H等[25]以MgAl2O4为载体, 用空气将乙醇选择性氧化为乙酸, 对生物乙醇的应用提供了新方向。Baiker P等[26]以Cu-Mg-Al三元复合氧化物为载体制备了纳米金催化剂, 发现载体碱性对醇的催化氧化具有一定促进作用。
醛氧化一般生成相应羧酸, 产率极高, 该反应可以在各种溶剂体系中进行, 对酸碱性环境的要求不高。与其他贵金属催化剂相比, 纳米金在水相中催化氧化醛性能更好, 特别是在应用过程中很少发生活性降低。Biella S等[27]将纳米金催化剂用于水溶性醛氧化反应中, 研究溶剂对催化活性的影响, 发现溶剂为CCl4时的反应活性明显优于CH3CN, 含氯溶剂可以提高再循环利用的产率。
3.1.4 H2O2直接合成
H2O2作为重要的无机化学品, 目前在工业上主要采用不环保的蕙酮法生产。在氢氧直接合成
3.2.1 不饱和烃还原
不饱和烯烃的加氢还原在工业生产中的应用很多, 单不饱和烯烃加氢的反应工艺相对成熟, 对催化剂要求不高。而对于多不饱和位的烯烃, 在还原加氢时由于结构的复杂性, 对催化剂选择性的要求较高。纳米金催化剂在选择性加氢还原中有着自身的优势, 在多不饱和位烯烃还原中具有很好的应用前景。
Segura Y等[30]在炔烃和烯烃混合加氢中使用了负载型纳米金催化剂, 发现活化能更低的炔烃更容易被还原, 认为活化能越高越难被吸附到金表面。Lopez-Sanchez J A等[31]使用多种载体制备了一系列纳米金催化剂, 用于丙炔加氢还原中, 结果表明, 二氧化钛为选择性最高的载体。
3.2.2 不饱和醛还原
不饱和醛选择性还原是合成精细化学品如医药中间体和香料等常见反应。通常不饱和醛加氢多为双键加氢生成饱和醛, 而不饱和醇选择性不高, 纳米金催化剂很好地解决了该难题。
Shibata M等[32]制备金-锆合金氧化物催化剂, 用于巴豆醛加氢反应, 研究表明, 催化剂可以高选择性生成巴豆醇, 用于对比的钯催化剂则生成饱和羰基化合物。Milone C等[33]以三氧化二铁为载体制备了纳米金催化剂, 用于柠檬酸加氢反应, 柠檬酸可完全被转化, 产物选择性非常高, 认为载体三氧化二铁起到活化C 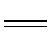
3.2.3 硝基化合物还原
硝基化合物是工业上用量较大胺类化合物的主要合成原料。工业上对于硝基化合物选择性加氢还原, 使用较多的是雷尼镍催化剂, 贵金属催化剂主要以铂族金属为主, 选择性差。
Corma A等[34]以二氧化钛为载体, 制备了纳米金催化剂, 用于硝基苯加氢反应, 结果表明, 在1-硝基-1-环己烯还原成ε -己内酰胺的反应中选择性非常高, ε -己内酰胺是合成尼龙-66的关键原料之一, 为工业生产提供了一条新工艺。Tan Y等[35]以锌铝水滑石为载体, 环境友好的半胱氨酸为保护剂, Au25原子团簇为前驱体, 制得纳米金催化剂, 该催化剂对硝基加氢活性很高, 而对碳碳双键加氢基本没有活性, 非常适用于不饱和芳香硝基化合物的选择加氢反应。
3.3.1 汽车尾气净化
纳米金催化剂能低温条件下催化CO的氧化和氮氧化物的还原, 并且可以加速烃类物质的燃烧, 展现出良好的应用前景。
美国一家公司以纳米金替代了铂, 用于处理柴油车尾气, 改用金催化能使CO催化氧化活性提高20%以上, 从而延长发动机使用寿命。国内在这方面也做了很多研究工作, Wei Y C等[36]研发出可用于尾气处理的纳米金催化剂, 有望推出产品, 进入市场。
3.3.2 环境污染治理
纳米金催化剂在净化空气中的CO、甲醛等有害气体和挥发性有机物的催化燃烧以及废水中含氯烃类和氯氟烃类的催化分解等方面有不少的研究成果。烟台大学和山东招金集团在2011年联合成立的山东省黄金工程技术研究中心, 是国内第一家研究纳米金催化技术的产学研相结合的机构, 为加快纳米金催化技术的产业化做出了不少贡献[37]。世界上最早将纳米金催化技术应用于环境净化的产品是日本松下集团, 将纳米金催化剂用于去除卫生间异味。纳米金催化剂还能够催化乙烯分解为CO2和H2O, 可以用作无毒害的蔬菜水果保鲜剂。
3.3.3 制造燃料电池
近年来, 作为新能源汽车主要动力来源之一的燃料电池成为各大汽车公司研究热门。低温水煤气转换反应中常使用铜作为催化剂活性组分, 但其对湿度较为敏感, 不适合用于汽车的燃料电池。而作为清洁能源技术关键材料的纳米金催化剂, 其高抗湿性和低温CO消除的特性很适合通过水煤气转换反应为燃料电池提供清洁的氢能。纳米金催化剂除了能在水煤气转化反应中为燃料电池提供氢源外, 还可以从氢气流中去除微量CO, 并且可以降低燃料电池的使用温度、提升使用效率。
与过渡金属和铂族贵金属相比, 纳米金催化剂特点为:(1) 金粒径要足够小才会获得催化活性, 例如在CO低温催化氧化中, 纳米金粒径需小于5 nm; (2) 与铂族金属相比, 纳米金催化剂在低温下表现出的活性和选择性较高; (3) 对环境湿度不敏感, 甚至活性随湿度的增大而升高。
随着负载型纳米金催化剂CO催化氧化性能的研究工作不断深入, 虽然已研制出许多具有优异性能的纳米金催化剂, 但现阶段要达到成熟的规模化生产, 并广泛应用, 依然存在很多问题:(1) 催化生产成本较高, 制备过程较复杂, 可重现性和催化稳定性较差; (2) 载体对纳米金催化剂活性的影响还需要系统和深入探究; (3) 对于负载型纳米金催化剂CO催化氧化反应机理和催化剂失活机理的研究还存在一些分歧[38]。
近年来纳米金催化剂的研究发展势头迅猛, 已经有了一定的深度和广度, 距离工业化越来越近, 在工业催化和环境保护等领域显现出重要的发展前景和商机。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|

