作者简介:黄树楷,1990年生,男,在读硕士研究生。
提出了拟薄水铝石胶溶机理。利用FT-IR、粒度和Zeta电位及TEM表征,通过不同酸铝比和胶溶时间微观变化过程,探究拟薄水铝石(Al)O-H羟基数目与胶溶性的关系,结果表明,(Al)O-H羟基数越大,胶溶性越好。 n(H+): n(AlOOH)=0.05~0.6时,随着酸量增加,粒径变小,Zeta电位变大,溶胶趋于稳定; n(H+): n(AlOOH)=0.7时出现凝胶,粒径变大。
A peptization mechanism of pseudo-boehmite was proposed in this work.The relationship between the number of (Al)O-H hydroxyl groups and the peptzing ability was researched by means of FTIR,particle size,Zeta potential and TEM. n(H+): n(AlOOH) of sol-gelation process and peptizing times were investigated.It was found that the more the number of (Al)O-H hydroxyl groups,the better the peptization.When the n(H+): n(AlOOH) was between 0.05 and 0.6,as the amount of acid increased,the particle size became smaller and the Zeta potential became larger and the sol tended to be stable.Gel appeared when n(H+): n(AlOOH) was 0.7,particle size also became larger.
拟薄水铝石是很薄的褶皱片层状, 晶体粒径比薄水铝石小, 含水量比薄水铝石大, 是一种结晶度不够完整的一水软铝石[1], 具有高比表面积、胶溶性好、黏结性强和孔容大等特点, 可用于催化剂、催化剂载体和分子筛等领域[2, 3]。
拟薄水铝石的胶溶性能是其内部结构的外在表现, 对拟薄水铝石产生胶溶性的本质原因有不同观点。苏秋成等[4, 5]认为拟薄水铝石内部水的存在形式有物理吸附水、片层结构水和结晶水3种, 而胶溶性主要取决于片层结构水和结晶水。Zheng Y S等[6]认为拟薄水铝石胶溶性是表面羟基与质子结合速率有关, 还与阴离子浓度有关。熊飞等[7]认为拟薄水铝石胶体中存在的双电层结构是导致其胶体具有稳定性的原因。蒙延双等[8]认为拟薄水铝石胶溶后存在酸性桥, 之间互相连接网形成溶胶。苗壮等[9]认为造成拟薄水铝石具有胶溶性的根本原因在于拟薄水铝石内由结晶水形成的羟基, 暴露在晶粒表面的羟基越多, 胶溶性越好。
Bleta R等[10]认为溶胶表面电荷较高时, 导致颗粒之间的静电排斥作用。Karouia F等[11]从研究胶溶样品纹理出发, 认为胶溶过程是勃姆石颗粒溶解后自组装成纳米粒子。蒙延双等[12]根据颗粒形貌的变化过程分为颗粒破碎和表面溶解两种作用机理。Zheng Y S等[6]研究了在不同酸度下的二次粒子, 认为胶溶过程颗粒尺寸变化分3个阶段。
本文探究拟薄水铝石表面羟基数目与胶溶性的关系及不同胶溶时间和不同n(H+): n(AlOOH)下微观变化, 提出拟薄水铝石胶溶机理。
拟薄水铝石和去离子水, 自制; 盐酸, 分析纯, 国药集团化学试剂有限公司。
拟薄水铝石通过正己醇铝水解制得, 干燥温度为100 ℃、160 ℃和600 ℃的样品分别标记为B1-100、B2-160和B3-600。
美国尼高力仪器公司Avater 370傅立叶变换红外光谱仪; 英国马尔文仪器有限公司Zetasizer Nano ZS纳米粒度、Zeta电位和绝对分子量分析仪; 日本电子株式会社JEM-2100透射电子显微镜。
胶溶指数是指在拟薄水铝石中可胶溶部分占总拟薄水铝石的质量百分数[13]。称取干燥样品(2~5) g, 置于250 mL锥形瓶中, 加入样品质量19倍去离子水的一半, 搅拌混合均匀, 剩余一半去离子水加入不同物质的量比的30%盐酸(按干燥样品质量的75%算)制成酸水溶液, 滴加全部酸水溶液到样品液中搅拌至透明, 取3份10 mL样品进行离心(4 000 r· min-1), 30 min后弃去上层清液, 剩余沉淀120 ℃, 干燥过夜, 称取得到的沉淀质量, 计算胶溶指数。
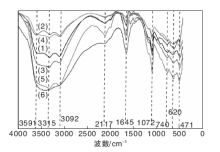
图1为B1-100、B2-160和B3-600的FT-IR谱图。从图1可以看出, 3 315 cm-1处为(Al)O-H的非对称弯曲振动, 约3 092 cm-1处为(Al)O-H的对称伸缩振动, 1 072 cm-1处为A1-O-H的对称弯曲振动, 740 cm-1、620 cm-1和471 cm-1处分别为扭曲AlO6八面体A1-O非对称扭转振动、Al-O弯曲振动和Al-O伸缩振动。
 | 图1 B1-100、B2-160和B3-600的FT-IR谱图 (1) B1-100; (2) B1-160; (3) B3-600Figure 1 FT-IR spectra of B1-100, B2-160 and B3-600 samples |
B1-100、B2-160和B3-600的(Al)O-H与Al-O峰面积积分比值如表1所示。
| 表1 B1-100、B2-160和B3-600的(Al)O-H峰面积与Al-O峰面积积分比值 Table 1 FTIR Peak area ratio of (Al)O-H/Al-O for B1-100, B2-160 and B3-600 samples |
从表1可以看出, B1-100的胶溶指数和(Al)O-H峰面积与Al-O峰面积积分比值高; B3-600胶溶指数低, 相对其他样品, 图1中3 315 cm-1几乎消失, 3 092 cm-1峰强变小, 峰宽变大, 几乎不能积分, 胶溶性较差, 铝羟基数量决定了胶溶能力的强弱, 表面羟基数目越多, 胶溶越容易进行。间接说明胶溶时, 质子氢与(Al)O-H的羟基结合后, 使拟薄水铝石脱落溶解。不同干燥温度下, 片层拟薄水铝石之间物理和化学吸附水的脱落导致羟基数量变化[14], 样品B3-600高温下片层直接水大部分脱离, 羟基减少, 从而影响胶溶性。
研究不同酸量下, 拟薄水铝石的胶溶过程, 不同n(H+): n(AlOOH)的B1-100的粒径体积分布见图2。
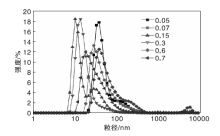 | 图2 不同n(H+): n(AlOOH) B1-100的粒径体积分布Figure 2 Particle size distribution of B1-100 with different n(H+): n(AlOOH) |
表2为不同n(H+): n(AlOOH)B1-100的平均粒径和Zeta电位。
| 表2 不同n(H+): n(AlOOH)的B1-100的平均粒径和Zeta电位 Table 2 Average particle size and Zeta potential of B1-100 with different n(H+): n(AlOOH) |
从表2可以看出, n(H+): n(AlOOH)=0.05~0.3时, 随着n(H+): n(AlOOH)增加, 平均粒径减小, 表明拟薄水铝石聚集体表面不断被剥离和溶解; n(H+): n(AlOOH)=0.6时, 平均粒径减小趋势减缓; n(H+): n(AlOOH)=0.7时, 此时样品呈现凝胶状, 平均粒径增大。n(H+): n(AlOOH)≥ 0.3时, Zeta电位均大于36 mV, 表明溶胶趋于稳定[15], 质子从水中向胶粒表面迁移趋势更明显, 因此, 随着酸量增大, Zeta电位增加[16], 溶胶稳定性提高。
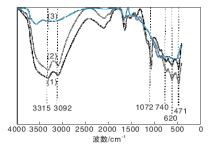
不同n(H+): n(AlOOH)的B1-100的FT-IR谱图及(Al)O-H峰面积与Al-O峰面积积分比值见图3和表3。
从表3可以看出, n(H+): n(AlOOH)=0.05~0.6时, 随着酸量不断增加, (Al)O-H峰面积与Al-O峰面积积分比值逐渐减少, 间接表明胶溶时质子氢不断“ 消耗” 拟薄水铝石表面的羟基, 形成胶粒, 脱离拟薄水铝石聚集体, 拟薄水水铝石聚集体变小; n(H+): n(AlOOH)=0.7时, 样品表面羟基几乎消耗完全, 通过氢质子的桥连作用, 胶粒之间形成凝胶, 图3中拟薄水铝石表面特征羟基3 315 cm-1和3 092 cm-1处吸收峰几乎消失, 出现了聚合OH吸收峰, 这也证明了胶溶本质就是质子氢与拟薄水铝石上羟基作用的过程。
| 表3 不同n(H+): n(AlOOH)B1-100的(Al)O-H峰面积与Al-O峰面积积分比值 Table 3 FTIR Peak area ratio of (Al)O-H/Al-O for B1-100 sample of different n(H+): n(AlOOH) |
不同胶溶时间n(H+): n(AlOOH)=0.6的B1-100的粒径体积分布见图4, 平均粒径和Zeta电位见表4。从表4可以看出, 随着胶溶时间增加, 平均粒径逐渐减小, Zeta电位逐渐增大, 胶溶前30 min, 样品平均粒径从95.16 nm减小至79.80 nm, Zeta电位从24.7 mV增至48.9 mV, 表明体系越来越稳定; 胶溶60 min, 平均粒径为32.91 nm, Zeta电位达到60.6 mV, 表明拟薄水铝石胶溶过程是由拟薄水铝石聚集体变成片状拟薄水的过程。
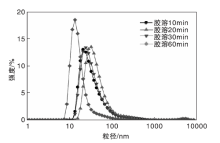 | 图4 不同胶溶时间n(H+): n(AlOOH)=0.6的B1-100的粒径体积分布Figure 4 Particle size distribution of B1-100 with different peptizationtime when n(H+): n(AlOOH)=0.6 |
| 表4 不同胶溶时间n(H+): n(AlOOH)=0.6的B1-100的平均粒径和Zeta电位 Table 4 Average particle size and Zeta potential of B1-100 with different peptization time when n(H+): n(AlOOH)=0.6 |
不同胶溶时间n(H+): n(AlOOH)=0.6的B1-100的TEM照片见图5。
 | 图5 不同胶溶时间n(H+): n(AlOOH)=0.6的B1-100的TEM照片Figure 5 TEM images of B1-100 with different peptization time when n(H+): n(AlOOH)=0.6 |
从图5可以看出, 拟薄水铝石胶溶前为薄片和针状堆叠成一定厚度的大聚集体, 胶溶30 min时, 出现了分散较为均匀的片状聚集体, 粒径约(30~100) nm。胶溶60 min后, 大聚集体和针状体消失, 形成不规则结构的小聚集体, 与红外分析一致。
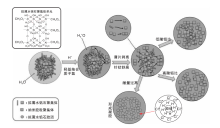
拟薄水铝石胶溶机理见图6。
拟薄水铝石聚集体单元表面含有大量羟基, 这些羟基具有较高活性。许多聚集体单元可以以薄片和针状堆叠成大聚集体, 在酸作用下, 拟薄水铝石表面羟基会结合溶液中的质子氢, 从大聚集体上以薄片或聚集体剥落, 同时针状单元结合质子氢后也舒展成小薄片单元, 形成纳米胶粒。在低n(H+): n(AlOOH)=(0.05~0.3)时, 体系中除了胶溶脱落后形成的纳米胶粒外还有未胶溶的聚集体, 此时Zeta电位随之增加, 胶溶体系越来越稳定。n(H+): n(AlOOH)=0.6时, 聚集体上所有羟基均被质子化, 体系中纳米胶粒以多种离子形态自聚, 在溶液中形成动态平衡。体系中拟薄水铝石聚集体被完全转化成纳米胶粒后, 此时再有质子氢存在时, 双电层胶粒被压缩, 聚集体互相连接, 最终形成空间网状结构的凝胶状态, 其机理过程如图6所示。
(1) 拟薄水铝石胶溶性与表面(Al)O-H羟基数目存在一定关系, 基数越大, 胶溶性越好。
(2) 拟薄水铝石盐酸胶溶过程中, n(H+): n(AlOOH)0.05~0.6时, 随着酸量增加, 粒径变小, Zeta电位变大, 溶胶趋于稳定, 此时接近完全胶溶。n(H+): n(AlOOH)0.7时出现凝胶, 粒径随之变大。
(3) 在质子氢存在下, 拟薄水铝石胶溶过程是大聚集体不断被剥离, 形成胶粒及其聚集体, 最终酸量过量时, 形成凝胶。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|