作者简介:高晓明,1979年生,男,博士,副教授,主要从事环境催化和能源化工的研究。
采用水热法合成了BiFeO3,使用光还原技术将AgCl沉积在BiFeO3表面,制备了具有可见光催化活性的AgCl/BiFeO3复合光催化剂,并利用XRD、SEM和UV-Vis DRS等分析了AgCl/BiFeO3异质结的物相、表面结构和光响应性等性能。结果表明,AgCl的沉积不仅改善了BiFeO3的表面结构,有效促进光生电子的迁移;而且扩宽了BiFeO3的光响应范围,提高了BiFeO3的可见光响应能力。以光催化降解模拟染料废水的效果评价其可见光催化性能。结果表明,Ag与Bi物质的量比为1:2时,AgCl/BiFeO3复合光催化剂对亚甲基蓝的降解效果最佳,光照210 min,降解率可达92.5%。AgCl/BiFeO3复合光催化剂具有良好的光催化稳定性,循环使用5次后,降解率仍能达到80%以上。
BiFeO3 was prepared by hydrothermal method,and then,AgCl/BiFeO3 composites with visible light photocatalytic activity was synthesized by photoreduction deposition of AgCl onto BiFeO3.The phase,surface structure and light response was characterized by the XRD,SEM,and DRS UV-Vis.Due to the deposition of AgCl,surface structure of BiFeO3 was improved,and the recombination of photogenerated electron/hole pair was effectively suppressed.Furthermore,the structure broadened the response range of visible light.The photocatalytic performance was investigated by degradation of simulated dye wastewater.The results showed that the degradation conversion to methylene blue on AgCl/BiFeO3 with Ag:Bi =1:2 was 92.5% in 210 min,higher than that of AgCl and BiFeO3.AgCl/BiFeO3 had good photocatalytic stability,and the degradation rate could reach more than 80% after recycling 5 times.
工业废水中含有许多难以降解的有机污染物(如偶氮类), 这些有机污染物具有毒性强、难分解, 且对环境影响持久等特点, 成为环境治理的难点[1, 2]。传统的废水处理方法主要有生物法、物理法和化学法等[3]。偶氮类有机污染物不能维持微生物生存, 因此导致生物法对染料废水失去降解能力[4]。物理法只是将污染物转变为另外一种形式存在, 不能彻底的无害化处理[5]。化学法需要大量的强氧化剂和还原剂, 投入高, 成本大, 而且会造成二次污染[6]。光催化氧化技术在有机污染物治理过程中表现出明显优越性, 如条件温和、不产生二次污染及深度降解等优点[7, 8, 9]。寻找与探索具有强氧化能力和宽谱响应的光催化剂成为该技术实现应用的关键。由于Bi系金属氧化物具有响应可见光激发的能带结构和高的电荷流动性[10, 11, 12], 使其成为研究热点。BiFeO3是种钙钛矿型Bi系金属氧化物, 禁带宽度(2.5~2.8) eV, 几乎响应(200~800) nm区域的所有光谱, 受到广泛关注[13, 14, 15]。虽然BiFeO3具有宽的光谱响应范围, 然而其光生载流子容易二次复合, 不能有效地吸收可见光区域以内的低频光子, 导致光能利用率不高。大量研究表明, 构建复合光催化剂体系是促进光生载流子的有效分离、改变载流子迁移路径的有效手段[16, 17, 18, 19]。AgCl是种新型表面等离子体光催化材料, 具有贵金属表面等离子体共振效应、金属半导体接触和半导体光催化材料的特性[20, 21, 22], 广泛用于光催化材料的表面修饰与改性。因此, 用AgCl修饰BiFeO3的表面结构, 形成复合光催化剂体系, 改变光生载流子的迁移方式, 抑制其二次复合, 叠加光谱范围, 可以解决BiFeO3宽的光响应范围与低的量子效率间的矛盾。
本文采用水热法制备BiFeO3, 使用光还原技术将AgCl沉积在BiFeO3表面, 制备具有可见光催化活性的AgCl/BiFeO3复合光催化剂, 用XRD、SEM、EDS和UV-Vis等对催化剂进行分析表征, 并以亚甲基蓝为降解对象, 研究AgCl/BiFeO3复合光催化剂的光催化性能, 探讨光催化降解机理。
硝酸铁, 分析纯, 国药集团化学试剂有限公司; 硝酸铋, 分析纯, 天津市科密欧化学试剂开发中心; 次甲基蓝, 分析纯, 天津市科密欧化学试剂开发中心; 硝酸银, 分析纯, 国药集团化学试剂有限公司; 氯化钾, 分析纯, 国药集团化学试剂有限公司; 聚乙二醇20000, 分析纯, 西安化学试剂厂。
XPA-7型光化学反应仪, 南京胥江机电厂; XRD-7000型全自动X射线衍射仪, 日本Shimadzu公司; UV-2550型紫外-可见分光光度仪, 日本Shimadzu公司; TM3000型扫描电镜, 日本Hitachi公司; Quantax70型能谱仪, 德国Bruker公司。
1.2.1 BiFeO3的制备
将0.01 mol的Bi2(NO3)3· 5H2O和0.01 mol的Fe(NO3)3溶于15 mL蒸馏水, 50 ℃恒温水浴震荡2 h。调节溶液pH值, 再震荡2 h, 加入聚乙二醇20000, 继续震荡30 min, 放入聚四氟乙烯反应罐, 密封后放入反应釜, 置于恒温箱, 160 ℃下保持10 h。自然冷却至室温, 离心得到沉淀物, 水洗3次, 过滤, 50 ℃干燥12 h, 收集样品备用。
1.2.2 AgCl/BiFeO3催化剂的制备
溶解1 mol的BiFeO3于乙二醇中, 将其分别与0.2 mol· L-1、1 mol· L-1、2 mol· L-1和3 mol· L-1的硝酸银溶液混合, 磁力搅拌30 min。将与硝酸银等浓度的氯化钾溶液缓慢加入上溶液中, 加入过程中持续磁力搅拌。400 W汞灯光照混合溶液1 h进行硝酸银的光还原反应, 将AgCl沉积在BiFeO3的表面。离心得沉淀物, 水洗3次, 过滤, 50 ℃干燥12 h, 收集样品, 备用, 标记为AgCl/BiFeO-1、AgCl/BiFeO-2、AgCl/BiFeO-3和AgCl/BiFeO-4。
样品结构在XRD-7000型全自动X射线衍射仪测定, CuKα , 工作电压40 kV, 工作电流100 mA, 扫描范围20° ~80° 。
样品紫外-可见光漫反射吸收光谱采用UV-2550型紫外-可见分光光度仪测定, 以BaSO4为参考, 测量范围(200~800) nm。
样品表面形貌及微结构采用TM3000型扫描电镜测定。
样品元素分析采用Quantax70型能谱仪测定。
样品光催化活性评价在光化学反应仪中室温和常压下进行。取一定量的样品加至20 mL模拟染料废水(浓度为10 mg· L-1的亚甲基蓝溶液)中, 避光旋转搅拌30 min, 达到吸附-脱附平衡后, 在400 W金卤灯下进行光催化反应, 反应完成后将溶液离心分离取上清液在UV-2550型紫外分光光度仪上测定吸光度。
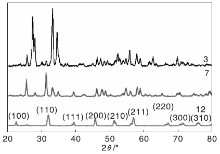
图1为不同pH值下制备的样品XRD图。
从图1可以看出, 在碱性条件(pH=12)下, 样品的特征衍射峰峰型尖锐, 主要特征衍射峰为22.4° 、32.2° 、39.5° 、45.8° 、51.3° 、57.0° 、67.1° 、71.5° 和76.1° , 分别对应(100)、(110)、(111)、(200)、(210)、(211)、(220)、(300)和(310)晶面, 与BiFeO3基本吻合, 未出现其他杂峰。可见该条件下制备的样品为纯相BiFeO3, 结晶度良好。在中性(pH=7)和酸性(pH=3)的条件下, 样品特征衍射峰峰型较宽, 峰强较弱, 结晶度较差, 在25.8° 、27.5° 、33.4° 、34.9° 、47.9° 、48.9° 、54.9° 、58.1° 、59.2° 和61.2° 等也出现了特征衍射峰。因此, 此条件下制备的样品为铁酸铋的混合晶相, 可认为是由BiFeO3、Bi2Fe4O9、Bi25FeO40、Bi24Fe2O39、Bi36Fe2O57、Bi46Fe2O72和Bi25FeO40等构成。原因可能是铁酸铋是由Bi(OH)3与Fe(OH)3络合而成, 在碱性条件下, 溶液中电离的OH-离子较多, 利于纯相BiFeO3的生成。
图2为AgCl/BiFeO3复合光催化剂的XRD图。
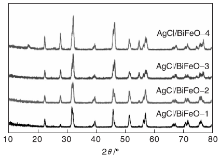 | 图2 不同条件下制备的AgCl/BiFeO3复合光催化剂的XRD图Figure 2 XRD patterns of AgCl/BiFeO3 samples with different preparation conditions |
由图2可以看出, 所有样品在22.4° 、32.2° 、39.5° 、45.8° 、51.3° 、57.0° 、67.1° 、71.5° 和76.1° 出现了特征衍射峰, 与BiFeO3基本吻合。在27.8° 、54.8° 和74.5° 出现的特征衍射峰, 与AgCl吻合。此外, 在32.2° 、45.8° 、57.0° 、67.1° 和76.1° 的AgCl特征衍射峰与BiFeO3的特征衍射峰融合加强, 说明AgCl沿着BiFeO3的(110)、(200)、(211)、(220)和(310)晶面生长。随着银离子引入量的增加, AgCl特征衍射峰趋于明显, 样品特征衍射峰尖锐。在光还原反应过程中, AgCl在BiFeO3表面生长, 由于光的作用, 少量的单质银被还原出来, 附着于光催化剂的表面, 形成Ag颗粒。
表1为AgCl/BiFeO3复合光催化剂的晶胞参数。由表1可以看出, 银离子掺杂量的不同, 使得BiFeO3的晶系由六方晶系变为三角晶系, 最后又转变为六方晶系。晶系之间的转变会改变样品内部激子向表面迁移的方式和速率, 影响其光催化性能。
| 表1 AgCl/BiFeO3复合光催化剂的晶胞参数 Table 1 The crystal cell parameters of AgCl/BiFeO3 heterojunction samples |
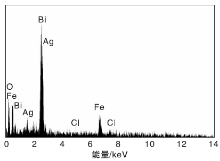
图3为AgCl/BiFeO3-3复合光催化剂的EDS谱图, 其元素组成见表2。从图3和表2可以看出, AgCl/BiFeO3-3复合光催化剂中主要存在元素为Fe、Bi、O、Ag和Cl, 且Fe、Bi、O元素含量比为1: 1: 3, Ag、Cl元素含量比1: 1。
| 表2 AgCl/BiFeO3复合光催化剂的元素组成 Table 2 Elemental composition of AgCl/BiFeO3heterojunction samples |
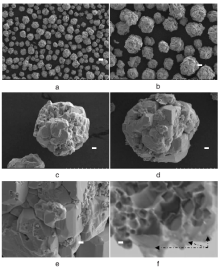
图4为AgCl/BiFeO-3复合光催化剂的SEM和TEM照片。
由图4可以看出, 合成的AgCl/BiFeO3复合光催化剂是由不规则块体自组装堆积成类似于球状的颗粒, 颗粒直径约为20 μ m, 形状均一。由TEM照片可以看出, AgCl微晶高度分散在BiFeO3颗粒的外表面, AgCl微晶与BiFeO3颗粒紧密接触, 在BiFeO3表面形成AgCl/BiFeO3异质结, 提高了材料的光量子效率, 增强了光催化活性。这也验证了XRD和EDS的结果。
BiFeO3的形成是晶体成核过程与生长过程共同作用的结果, 图5描述了BiFeO3的热力学生长过程。在水热反应初期, 由于动力学作用, Bi(NO3)3和Fe(NO3)3反应生成大量的BiFeO3晶核。随着反应的进行, BiFeO3在内在各向异性作用下, 晶核聚集在一起, 生成二维不规则BiFeO3颗粒。此时, 颗粒具有较高的表面能量, 为了降低其表面自由能, 二维不规则BiFeO3颗粒自组装成球状颗粒。
图6为纯AgCl、BiFeO3和AgCl/BiFeO3复合光催化剂的可见-紫外漫反射光谱图。
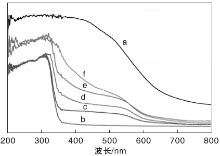 | 图6 AgCl、BiFeO3和AgCl/BiFeO3的可见-紫外漫反射光谱图Figure 6 UV-Vis DRS of AgCl, BiFeO3 and AgCl/BiFeO3 (a.AgCl; b.BiFeO3; c.AgCl/BiFeO3-1; d.AgCl/BiFeO3-2; e.AgCl/BiFeO3-3; f.AgCl/BiFeO3-4) |
从图6可以看出, 由于半导体的带隙跃迁, 纯BiFeO3在380 nm处, 吸收边界急剧下降, 其对紫外光线有吸收能力。AgCl/BiFeO3复合光催化剂的光吸收谱明显异于纯BiFeO3, 当BiFeO3的表面负载AgCl后, AgCl/BiFeO3复合光催化剂在可见光区域的吸收响应能力增强, 并且随着AgCl负载量的增加, AgCl/BiFeO3复合光催化剂的吸收边界相比纯BiFeO3发生了红移, 有利于光催化剂吸收更多的光子, 提高光的利用率, 光生电子-空穴对的生成速率增加, 从而使其显示出较高的催化活性。另外, AgCl/BiFeO3复合光催化剂在540 nm出现吸收峰, 这是AgCl的直接带隙所导致。与纯AgCl相比, AgCl/BiFeO3复合光催化剂的吸收边界发生了蓝移, 这可能是由于AgCl和BiFeO3的相互作用。
图7为不同催化剂光催化降解亚甲基蓝的性能。
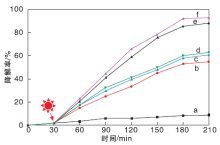 | 图7 不同AgCl/BiFeO3降解亚甲基蓝的效果Figure 7 Degradation effect of MB on different samples (a.空白; b.BiFeO3; c.AgCl/BiFeO-1; d.AgCl/BiFeO-2; e.AgCl/BiFeO-3; f.AgCl/BiFeO-4) |
从图7可以看出, 在没有光照的前30 min, 亚甲基蓝几乎不降解。可见达到吸附-脱附平衡时, 光催化剂对亚甲基蓝没有吸附作用。在没有催化剂加入, 光照210 min时(空白实验), 亚甲基蓝浓度基本不发生变化。因此, 光照无法破坏亚甲基蓝的结构, 不能使其发生降解。光照210 min, BiFeO3对亚甲基蓝的降解率为54%, 而AgCl/BiFeO-1、AgCl/BiFeO-2、AgCl/BiFeO-3和AgCl/BiFeO-4对亚甲基蓝的降解效果明显优于BiFeO3。光照210 min, AgCl/BiFeO-1对亚甲基蓝的降解率为60%。相对于AgCl/BiFeO-1, AgCl/BiFeO-2对亚甲基蓝的降解率只提高3个百分点。AgCl/BiFeO-3对亚甲基蓝的降解效果最佳, 光照210 min, 降解率可达92.5%。
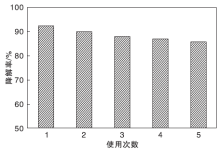
图8为AgCl/BiFeO-3复合光催化剂的光催化活性稳定性能。从图8可以看出, 在连续使用5次后, AgCl/BiFeO-3复合光催化剂对亚甲基蓝的降解率仍可达85%以上。
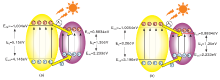
BiFeO3的导带位置为+0.883 eV, 价带位置为+2.233 eV, 禁带宽度为1.35 eV[23]。AgCl有直接带隙和间接带隙两种带隙, 直接带隙的导带位置为-1.004 eV, 价带位置为+4.146 eV, 禁带宽度为3.15 eV, 间接带隙的导带位置为-0.054 eV, 价带位置为+3.196 eV, 禁带宽度为5.25 eV[24](见表3)。因此, BiFeO3与AgCl可以生成两种形式的异质结:BiFeO3与AgCl(间接)形成异质结(图9a)和BiFeO3与AgCl(直接)形成的异质结(图9b)。这两种异质结的电荷转移路径不同。
| 表3 BiFeO3和AgCl的绝对电负性、带隙能、相对于标准氢电极的导带底和价带顶 Table 3 Absolute electronegativity, the band gap, relative potential energy conduction band and valence band edge to the standard hydrogen electrode of BiFeO3 and AgCl |
光照第一种形式的异质结, 光生电子由AgCl表面转移到BiFeO3表面, 使BiFeO3的带隙变得很窄, 虽然光生电子的转移有利于增加光生电子的寿命, 但还会导致电子空穴复合概率的增加, 而且复合反应基本在BiFeO3表面进行, 竞争光催化活性位点。所以这种结合不利于光催化反应。而光照第二种形式的异质结时, 在AgCl和BiFeO3表面产生光生电子-空穴对(式1、式2), 这些载流子并不能全部有效分离, 会有部分发生复合并以热能的形式传播出去, 这部分的能量没有被有效利用(式3)。
Ag在光照下生成激发态Ag* (式4), Ag* 失去电子生成Ag+* , 而自由电子激发至AgCl的导带上(式5); 激发至BiFeO3导带的光生电子迁移至AgCl导带(式6), 迁移富集在AgCl导带的光生电子与O2结合生成·
AgCl+hv → AgCl (e-+h+) (1)
BiFeO3+hv → BiFeO3 (e-+h+) (2)
e-+h+ → heat (3)
AgCl+hv → Ag* (4)
Ag* +AgCl → AgCl(e-)+Ag+* (5)
AgCl+BiFeO3 (e-) → BiFeO3+ AgCl(e-) (6)
BiFeO3+AgCl(h+) → AgCl+BiFeO3(h+) (7)
O2+ e-→ ·
·
2e-+HO2· +H+→ · OH+OH- (10)
BiFeO3(h+)+H2O → H++OH (11)
BiFeO3(h+)+OH- → OH (12)
AgCl(h+)+Cl- → AgCl+Cl0 (13)
(Cl0+· OH+·
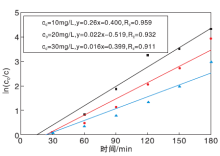
在不同初始浓度(10 mg· L-1、20 mg· L-1和30 mg· L-1)的废水中, 拟合AgCl/BiFeO3复合光催化剂对亚甲基蓝的一级动力学, 结果如图10所示。从图10可以看出, 不同初始浓度的ln(
光催化反应过程为多相表面反应, 可用Langmuir-Hinshewood(L-H)动力学模型来描述[25]。由于光催化降解反应机理复杂, 所以只考虑初始时刻的动力学问题, 光催化降解过程动力学模型限于最初阶段光催化降解分析[26], 则L-H动力学模型方程可以表达为:
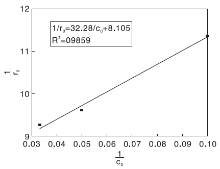
式中, k为反应速率常数, mg· (L· min)-1; KL-H为吸附平衡常数, L· mg-1; c0为初始浓度, mg· L-1, r0为初始反应速率。利用
因此, 可求得Langmuir-Hinshewood动力学模型方程为:
求得Langmuir - Hinshewood动力学参数:k=0.954 mg· (L· min)-1, KL-H=0.038 L· mg-1。
由以上的计算结果可以看出k> > KL-H, 表明AgCl/BiFeO3复合光催化剂对亚甲基蓝的吸附量很小, 即cKL-H< < 1, 光催化反应速率大于吸附速率, 吸附在光催化表面的亚甲基蓝迅速被光催化氧化降解, AgCl/BiFeO3复合光催化剂对亚甲基蓝的光催化反应动力学方程可以化简为一级反应。
(1) 利用水热-光还原法制备了具有可见光催化活性的AgCl/BiFeO3复合光催化剂。研究了pH、Ag与Bi物质的量比对AgCl/BiFeO3复合光催化剂的物相、表面结构及光响应性等性能的影响。结果表明, AgCl的沉积不仅改善了BiFeO3的表面结构, 有效促进光生电子的迁移; 而且扩宽了BiFeO3的光响应范围, 提高了BiFeO3的可见光响应能力。
(2) 以亚甲基蓝为目标污染物, 研究了AgCl/BiFeO3复合光催化剂在可见光下的光催化降解有机污染物的性能。结果表明, Ag与Bi物质的量比为1: 2时光照210 min, AgCl/BiFeO3复合光催化剂对亚甲基蓝的降解率可达92.5%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|