作者简介:张 晗,男,1993年生,江苏省连云港市人,在读硕士研究生,研究方向为生物催化。
以石墨粉为原料,使用改进Hummer法制备氧化石墨烯,采用沉积法固定化α-淀粉酶,并对固定条件进行优化。分别采用NaOH-CH2ClCOOH法和HNO3-H2SO4法制备羧基化氧化石墨烯,并将其用于固定化α-淀粉酶。结果表明,沉积法固定化酶的最适宜温度为65 ℃,最适宜pH=7.0。连续催化反应9次后,固定化酶活力仍能保持初始固定化酶活力的47.81%。经比较发现,NaOH-CH2ClCOOH法更有利于羧基化氧化石墨烯的制备,该方法制备的羧基化氧化石墨烯产率为HNO3-H2SO4法的1.2倍。
Graphite powder was used as raw material to prepare graphene oxide by improved Hummer method,and α-amylase was immobilized by deposition method and the immobilization conditions were optimized.The carboxylated graphene oxide was prepared by NaOH-CH2ClCOOH and HNO3-H2SO4,respectively,and used for immobilizing of α-amylase.Results showed that the optimum temperature for immobilization of the enzyme was 65 ℃ and the optimum pH was 7.0.After 9 consecutive using,activity for enzyme immobilization remained 47.81% of the initial activity.It was found that NaOH-CH2ClCOOH was more conducive for preparation of carboxylated graphene oxide.Yield of carboxylated graphene oxide prepared by NaOH-CH2ClCOOH was 1.2 times than by HNO3-H2SO4.
α -淀粉酶(1, 4-α -葡聚糖葡聚糖水解酶)水解淀粉中的α -1, 4-糖苷键得到糊精、低聚糖和单糖, 在食品工业、酿造工业和医药等领域应用广泛[1, 2]。α -淀粉酶来源较广, 可以从植物和动物中提取, 是较早工业化应用的酶类。但是在使用过程中, 由于游离酶分散在产品中, 回收困难, 不仅酶的使用量较大, 浪费资金, 而且给产品的进一步纯化带来麻烦。因此, 对α -淀粉酶进行固定化显得非常重要[3]。
石墨烯作为纳米材料中明星材料性能优良, 氧化石墨烯(GO)作为石墨烯的衍生物, 具有高比表面积和良好的生物相容性, 且表面含有丰富的官能团, 是固定化酶的理想载体, 其表面的羧基、羟基、羰基和环氧基可以通过结合力较弱的非共价键或共价偶联的方式将酶固定化到氧化石墨烯(GO)上[4, 5, 6]。
本文以石墨粉为原料, 采用改进Hummer法制备氧化石墨烯, 在不添加其他任何试剂的情况下, 使酶沉积到氧化石墨烯表面。分别以HNO3-H2SO4法[7]和NaOH-CH2ClCOOH法[8]制备羧基化氧化石墨烯(GO-COOH), 将两种方法制备的氧化石墨烯运用到α -淀粉酶固定化中, 并对固定化结果进行初步比较。
Ultrospec 7000型紫外分光光度计, 美国GE公司; TG1650-W型高速离心机, 湖南沪康离心机有限公司; TWCL-G型磁力搅拌器, 郑州生元仪器有限公司; KX-1740QT型超声洗涤器, 北京科玺世纪科技有限公司等。
石墨粉, 8 000目, 99.95%, 上海麦克林生化科技有限公司; α -淀粉酶, 23.7 units· mg-1, 北京索莱宝科技有限公司; 戊二醛, 50%, 上海麦克林生化科技有限公司; 乙二胺, 分析纯, 天津科密欧化学试剂有限公司; 一氯乙酸, > 99.95%, 天津威晨化学试剂科贸有限公司; 3, 5二硝基水杨酸, > 98.0%, 天津市河东区红岩试剂厂; 浓硫酸、高锰酸钾、硝酸钾、可溶性淀粉、磷酸氢二钠、柠檬酸, 均为分析纯, 上海桃浦化工厂。
配制不同pH值的0.1 mol· g-1磷酸氢二钠-柠檬酸缓冲液。
采用pH=6磷酸缓冲液配制10 mg· mL-1的α -淀粉酶溶液; 1%淀粉溶液, 4 ℃保存。
DNS试剂配制及Folin-酚试剂配制见文献[9]。
采用改进Hummer法制备氧化石墨烯, 称取1 g石墨粉和1 g硝酸钾, 加入锥形瓶, 再加入44 mL浓硫酸, 将锥形瓶放入冰水浴中, 磁力搅拌, 取6 g高锰酸钾缓慢加入锥形瓶(温度控制在4 ℃以下), 控制温度继续反应90 min。反应结束后, 移至提前预热好的60 ℃水浴中继续反应30 min, 再缓慢加入88 mL去离子水(约3秒1滴), 之后向锥形瓶中滴加30%过氧化氢, 每次20 μ L, 至溶液变成亮黄色。用0.5 mol· L-1的盐酸溶液进行离心清洗(速率8 000 r· min-1), 清洗至上清液用氯化钡检测无白色沉淀产生, 再用去离子水清洗, 洗至pH值为中性后超声10 h(冰水浴), 4 ℃保存备用。
沉积法制备固定化酶。量取1 mL氧化石墨烯溶液, 放入试管中, 加入3 mL磷酸缓冲液(pH=6)和1 mL的α -淀粉酶溶液(10 mg· mL-1), 5 ℃放置(428) h, 取出后用pH=6磷酸缓冲液洗涤。
1.5.1 HNO3-H2SO4法
取1 mL氧化石墨烯, 加入3 mL浓硝酸和9 mL浓硫酸, 超声3 h(冰水浴)[7], 反应结束后, 无离子水离心洗涤。
1.5.2 NaOH-CH2ClCOOH法
量取1 mL氧化石墨烯, 加入10 mL无离子水、0.5 g的NaOH和0.9 g的CH2ClCOOH, 超声3 h(冰水浴), 反应结束后, 无离子水离心洗涤[8]。
各样品中所用试剂如表1所示, 反应温度为室温, 反应时间2 h。
| 表1 官能化氧化石墨烯试剂添加量对比 Table 1 Comparison of reagent addition amount for functionalized graphene oxide |
取各样品1 mL, 分别加入3 mL缓冲液和1 mL酶液, 5 ℃放置8 h后取出洗涤, 收集滤液, 采用Folin-酚法测定蛋白质含量, 分别测定固定化前、后溶液的蛋白质浓度, 采用下式计算α -淀粉酶在载体上的负载率[9]:
负载率=
1.7.1 标准曲线制作
麦芽糖标准曲线的绘制按照文献[9]进行。麦芽糖标准溶液浓度为1 mg· mL-1, 结果利用Excel中相关统计分析工具, 完成回归方程计算, 得到标准曲线:y=0.7237x-0.034(R2=0.997 9)。
1.7.2 α -淀粉酶活力测定
α -淀粉酶活力单位定义:每分钟产生1 mg麦芽糖的量作为一个活力单位U。
以2 mL、1%淀粉溶液为底物, 加入1 mL磷酸缓冲液, 60 ℃预热10 min, 加入适量固定化酶, 准确反应5 min后取出, 立即加入0.4 mol的NaOH溶液, 使酶失活(在操作稳定性测试中, 取出后立即放入冰水浴中, 降低酶活力, 减小误差), 经离心, 取2 mL上清液, 加入2 mL的 3, 5-二硝基水杨酸试剂, 沸水浴5 min, 定容至25 mL, 在520 nm处测定其吸光度[9]。
α -淀粉酶酶活力=麦芽糖毫克数×
式中, N为酶液稀释倍数; 反应时间5 min。
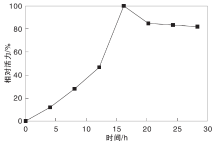
2.1.1 沉积时间对固定化α -淀粉酶的影响
在1 mL氧化石墨烯溶液中加入1 mL酶溶液(10 mg· mL-1, pH=6.0)、3 mL磷酸缓冲液(pH=6.0), 5 ℃下分别放置4 h、8 h、12 h、16 h、20 h、24 h、28 h和32 h, 沉积结束后, 取出离心洗涤, 测定酶活力, 结果如图1所示。从图1可以看出, 16 h前, 酶活力呈上升趋势, 16 h酶活力达到最大值, 之后略降, 逐渐趋于平缓。可能是随着时间延长, 酶逐渐沉积到氧化石墨烯表面, 使酶载量逐渐升高, 酶活力逐渐提升, 氧化石墨烯表面负载酶达到基本饱和后, 酶活力不再增长, 且可能是由于载酶量的增加, 导致底物和产物的扩散受阻, 从而导致酶活力略降, 因此选取16 h为最佳沉积时间。
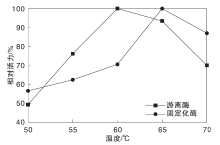
2.1.2 温度对酶活力的影响
使用最佳沉积时间16 h, 其他固定化条件不变, 在50 ℃、55 ℃、60 ℃、65 ℃、70 ℃下, 测定固定化酶和游离酶活力, 结果如图2所示。
 | 图2 温度对游离酶和固定化酶相对活力的影响Figure 2 Effect of temperature on relative activity of free and immobilized α -amylase |
从图2可以看出, 酶活力的最佳温度有所提高, 由60 ℃升高至65 ℃。且在测定范围固定化酶相对活力变化较平缓(固定化酶相对活力变化差值为43.6; 游离酶相对活力变化差值为57.8), 且相对活力均保持在56.4%以上, 可能是由于经固定化后, 酶蛋白结构更加稳固, 从而使固定化酶对温度耐受性有所提高。
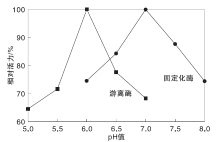
2.1.3 pH值对酶活力的影响
其他固定化条件不变, 在pH=5.08.0, 采用0.1 mol· L-1磷酸氢二钠和0.1 mol· L-1柠檬酸分别配制pH为5.0、5.5、6.0、6.5、7.0、7.5和8.0缓冲液, 在不同pH值条件下测定固定化酶和游离酶活力, 结果如图3所示。
由图3可以看出, 固定化酶最适宜 pH=7.0, 游离酶的最适宜pH=6.0, α -淀粉酶对pH值的变化较敏感, 在偏离各自最适宜pH值后, 固定化酶和游离酶的相对活性均变化较大, 但与游离酶相比, 固定化酶分子结构可能是由于受到氧化石墨烯的保护, 其对pH值的敏感程度有所降低, 且更偏向于中性。
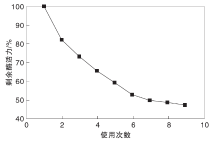
2.1.4 固定化酶的操作稳定性
以1%淀粉溶液为底物, 在最适宜温度65 ℃和最适宜pH=7.0下, 将固定化酶连续进行9次催化反应, 测定其酶活力, 以首次酶活力为100%计算剩余酶活力, 结果如图4所示。
由图4可以看出, 在初次使用之后, 酶活力下降明显(18.44%), 可能是由于部分负载酶结合不牢固, 导致使用中酶发生脱落, 酶活力下降。第2次到第6次的酶活力变化相对均匀, 这可能是由于沉积在表面或裸露较明显的酶在多次的使用中发生脱落或是变性, 从而使酶活力降低。在之后的使用中, 氧化石墨烯表面留下的酶基本都在氧化石墨烯的片层或凹槽中, 可以得到氧化石墨烯良好的保护, 因此, 在第6次使用之后, 固定化酶活力没有明显变化。重复使用9次之后, 酶活力仍能保持47.81%, 表明氧化石墨烯负载酶具有较好的重复使用性。
8个官能化氧化石墨烯样品的溶液外观如图5所示。从图5可以看出, NaOH-CH2ClCOOH法处理的氧化石墨烯颜色较深(1、3、6、8号样品), 可能是氧化石墨烯在处理的过程中分散性变差导致溶液颜色偏深, 经过比较, HNO3-H2SO4法处理的氧化石墨烯产率相对低, 仅为NaOH-CH2ClCOOH法的83.39%。
图6为不同官能化氧化石墨烯固定化α -淀粉酶相对活力及负载率。
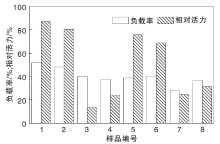 | 图6 不同官能化氧化石墨烯固定化α -淀粉酶相对活力及负载率Figure 6 Relative activity and loading rate of immobilized enzyme on different functionalized graphene oxide |
从图6可以看出, 两种方法制备的羧基化氧化石墨烯负载率没有明显差距, 最高值为1号样品, 仅为51.60%, 由此得出原酶溶液加入偏多, 需适当减少。戊二醛既是交联剂, 又是酶的失活剂, 因此, 戊二醛使用量直接影响到酶活力。没有添加戊二醛的载体(1, 2, 5, 6)均能较好地保留酶的活性, 添加2%戊二醛的样品, 最高保留游离酶活力的31.2%, 最低仅为13.35%, 因此戊二醛使用量还需进一步优化。在操作条件相同情况下, 两种方法所作载体在固定α -淀粉酶的应用中并没有明显差距, 但NaOH-CH2ClCOOH法由于产率较高, 且避免了浓酸的使用, 安全性较好, 因此更值得使用。
(1) 采用改进Hummer法制备氧化石墨烯, 在不添加其他试剂的情况下, 使酶沉积到氧化石墨烯上, 沉积法固定化α -淀粉酶最适宜pH为7, 最适宜温度为65 ℃, 连续使用9次后, 酶活力仍保持初始酶活力的47.81%, 表现出较好的稳定性。
(2) 分别采用HNO3-H2SO4法和NaOH-CH2ClCOOH法制备官能化氧化石墨烯, 并应用于α -淀粉酶的固定, 两种载体对酶影响虽然没有明显差距, 但NaOH-CH2ClCOOH法所得产率较高, 显示出一定优势。质量分数2%戊二醛对酶活性影响较大, 酶活力损失较严重, 戊二醛最佳添加量, 还需要进一步优化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|