作者简介:程荧荧,1993年生,女,在读博士研究生,主要从事光催化、光电催化还原CO2反应的研究。
以氮化碳(g-CN)为原料,采用水蒸汽焙烧剥离法在Ar/H2O氛围下制备薄层氮化碳(H-g-CN),并对其进行XRD、TEM、FT-IR、BET和UV-Vis DRS等表征。结果表明,进行剥离后,H-g-CN比表面积相比剥离前明显增大。H-g-CN的光催化还原CO2活性大大高于未剥离g-CN的活性,光照反应9 h, H-g-CN光催化还原CO2活性由剥离前的11.4 μmol·g-1提高至24.6 μmol·g-1,H-g-CN的CO选择性为91.2%,未剥离的g-CN的CO选择性为89.1%,并提出相应的反应机理。
The thin-layered carbon nitrides (H-g-CN) were successfully synthesized by calcination of carbon nitride (g-CN) in Ar/H2O atmosphere,and they were characterized by means of XRD,TEM,FT-IR,BET and UV-Vis DRS. It was found that,compared with g-CN,the specific surface area of H-g-CN obviously increased after calcination. The activity for C
化石能源驱动全球经济不断发展, 人类对能源的需求也在不断增长。目前能源消耗的主体仍然是不可再生的化石燃料, 化石燃料燃烧向大气中排放大量二氧化碳, 是造成温室效应主要气体之一。减少二氧化碳的途径主要有减排和对二氧化碳后处理。二氧化碳后处理分为深海掩埋、化学吸附储存和化学转化。化学转化之一是光催化还原CO2为人类可利用的现实资源, 以太阳能为能量, 模仿植物光合作用, 以人类自身过量排放的温室气体CO2和地球上丰富的水资源为原料, 将CO2通过光能量作用, 还原生成各种蕴含能量的还原性产物, 从而再次被现有的能源利用形式所消耗, 最终完成碳循环过程, 实现人类发展的能源需求和环境资源可持续利用的平衡发展。
氮化碳(g-CN)是一种新型的非金属半导体, 禁带宽度2.7 eV[1], 能够在可见光下产生光吸收, 是目前较为热门的光催化材料[2], 但存在缺陷, 块状g-CN比表面积小, 光生电子空穴对复合效率较高[3], 因此研究者致力于g-CN的改性工作[4], 改性最多的是将g-CN与其他催化剂进行复合改性, 在g-CN修饰的复合催化剂中, g-CN主要起两个方面作用, 第一为体系提供电子, 因为g-CN具有二维层状结构, 具有很多小的面内重复单元, 重复单元具有共轭结构, 因此g-CN具有一个大的共轭结构, 便于电子传输; 第二是与其他半导体起协同作用, 形成异质结, 促进光生载流子的分离与传输。
Li K等[5]将g-C3N4纳米点(尺寸约2.8 nm)涂覆在板钛矿型TiO2类纳米立方体上进行催化还原二氧化碳活性测定, 与单一板钛矿型TiO2、g-C3N4还原二氧化碳的活性进行对比, 并对CH4选择性进行研究。结果表明, 催化剂光催化活性高, CH4选择性高。这是因为:(1) g-CN纳米点尺寸小, 能够更好地对CO2产生吸附; (2) 异质结的形成促进了电子定向转移; (3) 复合催化剂对烃类和酸类的吸附为CH4的形成提供了额外的质子。
She X等[6]对类石墨相g-CN进行剥离改性, 得到薄层g-CN固体。经剥离后, 催化剂比表面积增大, 光解水产氢活性明显升高, 并且外量子效率达13.7%。
本文以三聚氰胺为原料、氯化铵为模板剂合成g-CN, 在Ar/H2O氛围下高温焙烧, 制得高比表面积薄层氮化碳(H-g-CN), 并进行光催化还原CO2性能研究, 根据反应活性评价结果, 提出相应的反应机理。
软模板法合成g-CN[7]:室温下向氯化铵溶液中加入 10 g三聚氰胺粉末充分混合搅拌均匀, 移至氧化铝瓷舟, 置于管式炉中以3.3 ℃· min-1升温速率升温至550 ℃, 恒温加热焙烧4 h。反应结束后降温, 所得淡黄色固体, 即为g-CN。
水蒸气焙烧剥离法合成H-g-CN[8]:将淡黄色固体g-CN放入氧化铝瓷舟, 在氩气和水蒸汽(Ar/H2O)氛围下以3.3 ℃· min-1升温速率在管式炉中升温至500 ℃, 恒温焙烧2 h, 反应结束后降温, 得到浅白色固体, 即为剥离后的H-g-CN。
XRD测定采用日本岛津公司XRD-6000衍射仪, CuKα , 扫描速率2° · min-1, 扫描角度15° ~90° 。
TEM表征采用日本JEOL公司JEM 2100透射电子显微镜, 灯丝为LaB6灯丝, 加速电压最高200 kV, 放大倍数(50 000~1 500 000)倍, 样品最大倾角± 35° 。
FT-IR表征采用美国Digilab公司FTS-3000型傅立叶红外光谱仪, 扫描范围(400~4 000) cm-1。
催化剂比表面积、孔道结构测定采用美国麦克仪器公司ASAP 2010型全自动比表面分析仪测定。
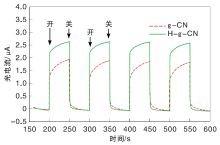
催化剂光电流与阻抗采用上海辰华仪器有限公司CHI660E电化学工作站三电极体系, 电解质溶液为0.1 mol· L-1硫酸钠溶液。
CO2-TPD采用Quantachrome autosorb-1型全自动吸附仪, 测定催化剂表面碱性位和CO2吸附量。
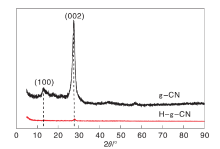
g-CN和H-g-CN的XRD图如图1所示。
由图1可以看出, 剥离前, g-CN在12.9° 和27.3° 有2个特征峰, 分别归属于g-CN的面内重复单元特征峰(100)以及层间堆积特征峰(002)。剥离后, 随着催化剂层间厚度降低, H-g-CN层间堆积特征峰强度明显降低, 面内重复单元特征峰逐渐消失[9]。
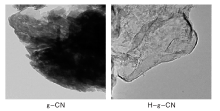
g-CN和H-g-CN的TEM照片如图2所示。
由图2可以看出, H-g-CN比g-CN厚度明显变薄, 出现了薄层状结构, 单层状结构明显。表明合成了g-CN和H-g-CN。
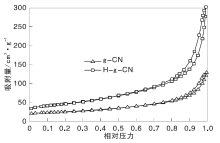
g-CN和H-g-CN的N2吸附-脱附曲线如图3所示, g-CN和H-g-CN的织构性能如表1所示。
| 表1 g-CN和H-g-CN的织构性能 Table 1 Pore volumes, pore diameters and specific surface areas of g-CN and H-g-CN |
由图3和表1可以看出, 剥离后, H-g-CN比表面积比剥离前明显增大, 由55.5 m2· g-1增至133.7 m2· g-1, 剥离后催化剂孔径与孔体积增大, 孔径由2.5 nm增至2.8 nm, 虽然处于介孔范围, 但实际上是由层状结构互相堆积形成的层间孔道。并且两种样品的层间孔径变化不大, 表明g-CN的层间孔形成比较稳定, 并不会受到催化剂厚度的影响。孔体积由0.19 mL· g-1增至0.47 mL· g-1。
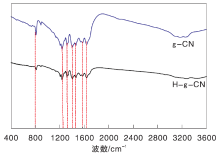
g-CN和H-g-CN的FT-IR谱图如图4所示。
由图4可以看出, 两种样品的特征峰主要集中在(800~1 800) cm-1和(3 000~3 300) cm-1。在波数801 cm-1处的特征峰归属于三嗪结构的特征峰, 而位于1 243 cm-1、1 315 cm-1、1 401 cm-1、1 468 cm-1、1 578 cm-1和1 644 cm-1处的特征峰则是归属于CN环的伸缩振动特征峰; 在(3 000~3 300) cm-1处的大宽峰是表面-NH物种中N— H键的伸缩振动峰。这部分基团主要来源是在合成过程中遗留的三聚氰胺中的未缩聚的氨基基团[10]。
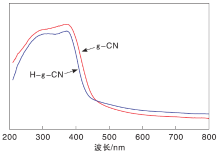
g-CN和H-g-CN的UV-Vis DRS谱图如图5所示。
由图5可以看出, g-CN的吸收区域为(200450) nm, 跨越了紫外和可见光区。H-g-CN的紫外吸收区域相较于剥离前发生了蓝移, 并且吸收强度略有降低。这是因为剥离使层间共轭结构变少[8], 改变了g-CN的表面电子结构, 从而紫外吸收区域变窄。
利用公式
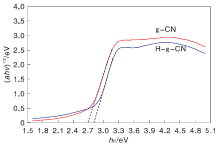 | 图6 g-CN和H-g-CN的Kubelka-Munk转换光谱Figure 6 Kubelka-Munk transformed reflectance spectra of g-CN and H-g-CN |
| 表2 g-CN和H-g-CN的禁带宽度 Table 2 The band gaps of g-CN and H-g-CN |
由图6和表2可以看出, 剥离后, H-g-CN的禁带宽度增大, 由原来的2.64 eV增至2.75 eV。
将剥离前的g-CN和剥离后的H-g-CN进行光催化还原CO2活性测试, 反应9 h, 催化剂光催化还原CO2活性、CO和CH4生成量、选择性和表观量子效率如表3所示。
| 表3 催化剂光催化还原CO2活性、CO和CH4生成量、选择性和表观量子效率 Table 3 TheCO2photocatalytic reduction activity, the CO and CH4 evolution amount, selectivity and apparent quantum efficiency of prepared samples |
由表3可见, 剥离后, H-g-CN光催化还原CO2活性相较比于剥离前大大提高。反应9 h, 未剥离的g-CN还原CO2活性为11.4 μ mol· g-1, 剥离后H-g-CN光催化还原CO2活性增至24.6 μ mol· g-1。并且两种催化剂光催化还原CO2产物对CO选择性均大大高于对CH4的选择性。反应9 h, g-CN对CO选择性为91.2%, H-g-CN对CO选择性为89.1%。剥离后, 催化剂还原CO2的表观量子效率由剥离前的0.49%上升至剥离后的0.51%。
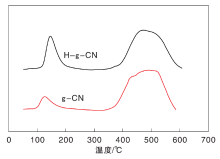
剥离后, 催化剂比表面积明显升高, 活性位点增多。在g-CN表面存在L碱性位, 对反应物分子CO2产生吸附。对剥离前后g-CN进行CO2-TPD表征, 结果如图8所示。
由图8可以看出, 剥离后, H-g-CN对CO2的吸附明显高于未剥离的g-CN。这是因为比表面积增大, 导致活性位点增多, 吸附量增大[11]。催化剂对CO2吸附量增大, 催化剂光催化还原CO2活性升高。
(1) 采用水蒸汽焙烧剥离法制备了具有单层状结构的H-g-CN。
(2) H-g-CN比表面积相比剥离前明显升高, 由原来的55.5 m2· g-1增大至133.7 m2· g-1, 大大增加了反应的活性位点。
(3) 剥离后, H-g-CN光催化还原CO2活性大大高于未剥离g-CN的活性, 由剥离前的11.4 μ mol· g-1增至24.6 μ mol· g-1。且两种催化剂对CO选择性大大高于对于CH4的选择性。
(4) 剥离后, H-g-CN的反应活性位点相比剥离前明显增多, 增大了对反应物分子CO2的吸附量, 提高了催化剂的CO2光催化活性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|