作者简介:王 凯,1993年生,男,在读硕士研究生,研究方向为精细化工。
制备了一系列Brønsted-Lewis双酸性离子液体催化剂,并将其应用于纤维素制备乙酰丙酸的实验中。考察催化剂种类、催化剂用量、反应温度、反应时间和催化剂重复使用次数对乙酰丙酸收率的影响,得到最佳工艺条件:[HO3S-(CH2)3-mim]Cl-FeCl3(FeCl3物质的量分数为0.60)用量0.62 mmol、纤维素用量0.50 g、反应温度180 ℃、反应时间10 h、去离子水用量为30 mL。在该反应条件下,乙酰丙酸收率为49.47%。通过甲基异丁基酮萃取可以分离出乙酰丙酸和催化剂。催化剂重复使用5次后,乙酰丙酸收率仍大于44%。采用SEM、XRD和TG-DTG对固体残余物进行表征,结果发现,纤维素转化成乙酰丙酸的过程中伴随着腐殖质的生成。
A series of Brønsted-Lewis ionic liquids (ILs) were prepared and employed in catalytic conversion of cellulose to levulinic acid (LA).Moreover,effects of type of ILs,dosage of ILs,reaction time,reaction temperature and repeated use of catalyst on yield of LA were investigated.The optimum reaction conditions were that amount of [HO3S-(CH2)3-mim]Cl-FeCl3(molar fraction of FeCl3 was 0.60) was 0.62 mmol,amount of cellulose was 0.50 g,reaction temperature was 180 ℃,reaction time was 10 h,amount of de-ionized water was 30 mL.Under the optimum conditions,the highest LA yield of 49.47% was obtained.LA and ILs could be separated by methyl isobutyl ketone extraction.LA yield exceeded 44% when IL was used repeatedly five times.In addition,the solid residue was characterized using SEM,XRD and TG-DTG.It was conducted that the by-product of humins was produced during the process of cellulose conversion.
随着煤炭、石油等不可再生资源的日益枯竭, 现代社会正处于巨大的资源和能源危机之中。纤维素作为一种可再生资源, 具有来源广泛、可持续性和成本低廉等优点, 利用纤维素制备乙酰丙酸已经成为研究热点[1, 2, 3, 4, 5, 6]。乙酰丙酸是一种具有羧基和羰基结构的新型平台化合物[7, 8, 9], 在医药、润滑油添加剂、树脂、涂料、染料、溶剂、橡胶塑料助剂以及表面活性剂等领域有着广泛的应用[10]。
乙酰丙酸的生成方法有多种, 传统方法是使用硫酸、盐酸等无机酸催化纤维素制备乙酰丙酸。虽然该方法生产工艺成熟, 但存在腐蚀设备、污染环境、催化剂难以回收等问题。与传统无机酸相比, 固体酸催化剂具有催化活性高、无污染、易回收等优点。Zuo Y等[11]采用CP-SO3H-1.15为催化剂, 在170 ℃催化反应10 h, 纤维素转化率85%, 乙酰丙酸收率24.3%。Fang Y等[12]利用S
离子液体作为一种新型的反应介质, 具有高催化活性、易回收和结构可设计等优点, 广泛应用于生物质领域。Li C等[13]首次将离子液体应用于纤维素制备葡萄糖, 通过实验发现, [C4mim]Cl与硫酸的混合体系葡萄糖收率达43%。Liu Y等[14]利用[C3HSO3Emim]HSO4催化纤维素, 100 ℃条件下还原糖收率达99%。Su Y等[15]将离子液体应用于纤维素制备5-羟甲基糠醛, 结果表明, [C2mim]Cl中添加CuCl2和CrCl3可使5-羟甲基糠醛产率达55%。Ren H等[16]采用SO3H官能化的酸性离子液体在微波辐射下将纤维素直接转化为乙酰丙酸, 乙酰丙酸收率55%。这些结果表明, 离子液体作为催化剂或助催化剂在生物质降解领域发挥了积极的作用。本文制备了12种Brø nsted-Lewis双酸性离子液体催化剂, 用于催化纤维素制备乙酰丙酸, 考察催化剂种类、催化剂用量、反应时间和反应温度对乙酰丙酸收率的影响, 探究催化剂重复使用性能, 并采用SEM、XRD和TG-DTG对产物乙酰丙酸和固体残余物进行结构表征。
纤维素, 99%, 成都市科龙化工试剂厂; 乙酰丙酸, 99%, 上海麦克林生化科技有限公司; 1, 3丙烷磺内酯, 99%, 国药集团化学试剂有限公司; N-甲基咪唑, 99%, 国药集团化学试剂有限公司; 三乙胺, 99%, 国药集团化学试剂有限公司; 吡啶, 99%, 国药集团化学试剂有限公司; 甲基异丁基酮, 99%, 天津市广成化学试剂有限公司。
高温高压反应釜100 mL, 大连理工大学; LC-20A高效液相色谱仪, 日本岛津公司; TU-1810紫外可见分光光度计, 北京普析通用仪器有限责任公司; pHs-259型pH计, 上海精科仪器有限公司。
按照Liu S W等[17]采用的方法制备离子液体[HO3S-(CH2)3-mim]Cl-FeCl3(FeCl3物质的量分数0.60), 将1, 3-丙烷磺内酯(0.5 mol)与乙酸乙酯混合, 80 ℃缓慢滴加N-甲基咪唑(0.5 mol), 滴加完毕搅拌反应2 h, 经乙酸乙酯洗涤3次, 80 ℃干燥2 h, 得到白色粉末, 即1-甲基-3-(丙基-3-磺酸)咪唑盐。取适量的1-甲基-3-(丙基-3-磺酸)咪唑盐溶解于去离子水中, 室温下缓慢滴加等物质的量的盐酸, 90 ℃反应2 h, 减压脱水, 得到白色产物即[HO3S-(CH2)3-mim]Cl。
氮气保护下, 将[HO3S-(CH2)3-mim]Cl(0.5 mol)与FeCl3(0.75 mol)在80 ℃反应至固体颗粒完全溶解, 即得Brø nsted-Lewis双酸性离子液体HO3S-(CH2)3-mim]Cl-FeCl3(FeCl3物质的量分数0.60)。参照该法可制得其他种类Brø nsted-Lewis双酸性离子液体。使用FT-IR和1H NMR表征离子液体的结构, 使用UV-Hammett(对硝基苯胺5 mg· mL-1, 离子液体25 mmol· L-1)和pH法(离子液体20 mmol· L-1))定量离子液体的酸值。
[HO3S-(CH2)3-mim]Cl-FeCl3:IR(KBr disc, cm-1):v3456, 3148, 3108, 2966, 2310, 1571, 1485, 1214, 1177, 1068, 850, 757, 695, 527; 1H NMR(500 MHz, D2O):δ 8.68(s, 1H), 7.44(s, 1H), 7.37(s, 1H), 4.28(t, 2H), 3.81(s, 3H), 2.81(t, 2H), 2.18(t, 2H)。
[HO3S-(CH2)3-NEt3]Cl-FeCl3:IR(KBr disc, cm-1):v3423, 2989, 1686, 1484, 1450, 1376, 1272, 1235, 1158, 1047, 913, 814, 604, 575, 501; 1H NMR(500 MHz, D2O):δ 3.34(m, 8H), 3.02(t, 2H), 2.16(t, 2H), 1.33(t, 9H)。
[HO3S-(CH2)3-py]Cl-FeCl3:IR(KBr disc, cm-1):v3420, 3127, 2950, 1632, 1581, 1488, 1300, 1239, 1140, 1034, 830, 751, 608, 523; 1H NMR(500 MHz, D2O):δ 8.83 (d, 2H), 8.49(t, 1H), 8.02(t, 2H), 4.69(t, 2H), 2.91(t, 2H), 2.39(t, 2H)。
称取0.62 mmol[HO3S-(CH2)3-mim]Cl-FeCl3催化剂、0.50 g纤维素和30 mL去离子水加入100 mL高温高压反应釜中, 在氮气保护下, 180 ℃反应10 h。反应结束后取出反应釜, 置于冰水中迅速冷却。取出反应液进行离心处理, 上层清液经0.45 μ m滤膜过滤后分析检测, 固体残渣80 ℃烘干5 h, 称重。乙酰丙酸和离子液体可以通过甲基异丁基酮(MIBK)萃取进行分离。
乙酰丙酸和5-羟甲基糠醛在HPLC液相色谱仪上进行测试, 色谱柱为Agilent TC-C18柱(4.6 mm× 250 mm, 5 μ m); 流动相为15 mmol· L-1的乙腈∶ 磷酸-磷酸二氢钠缓冲溶液=15∶ 85(pH=2.6), 流速1.0 mL· min-1; 柱温30 ℃; 进样量10 μ L; 紫外检测波长268 nm。葡萄糖使用DNS法检测。纤维素和固体残余物使用SEM、TG-DTG和XRD表征。
催化剂种类对乙酰丙酸收率的影响如表1所示。
| 表1 不同种类催化剂对纤维素转化合成乙酰丙酸反应的影响 Table 1 Effects of different catalysts on conversion of cellulose to levulinic acid |
由表1可见, Brø nsted-Lewis双酸性离子液体种类对纤维素转化合成乙酰丙酸反应结果影响显著。Brø nsted-Lewis双酸性离子液体的催化效果优于Brø nsted酸性离子液体, 其中, [HO3S-(CH2)3-mim]Cl-FeCl3表现出最佳的催化效果, 180 ℃反应10 h, 乙酰丙酸收率较高, 为49.47%, 纤维素转化率71.45%。但是, CrCl3作为Lewis酸的提供者时, 乙酰丙酸收率分别为33.31%、34.43%和32.00%, 接近于Brø nsted酸性离子液体催化条件下的乙酰丙酸收率, 这是因为CrCl3会抑制乙酰丙酸的生成[18]。离子液体具有相同阴离子结构时, 纤维素转化率和乙酰丙酸收率受阳离子影响不大; 离子液体具有相同阳离子结构时, 纤维素转化率和乙酰丙酸收率受阴离子影响较大, 这是因为Cl-可以更好地与纤维素的羟基结合, 促进纤维素氢键网络断裂, 从而打破纤维素广泛的氢键结构并促进其溶解[19]。
对硝基苯胺在不同离子液体水溶液中的紫外可见吸收光谱如图1所示。
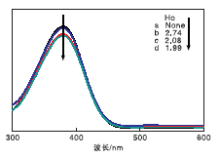 | 图1 对硝基苯胺在不同离子液体的水溶液中的紫外可见吸收光谱Figure 1 UV-visible spectroscopy of p-nitroaniline in water solution of ionic liquid a.空白; b.[HO3S-(CH2)3-NEt3]Cl; c.[HO3S-(CH2)3-py]Cl; d.[HO3S-(CH2)3-mim]Cl |
根据Brø nsted-Lewis双酸性离子液体的pH值和图1可以看出, 离子液体的酸度顺序为:咪唑基> 吡啶基> 三乙胺基。乙酰丙酸收率随着酸值的增加而呈现整体增长趋势, 这是因为酸性越强, 越能促进纤维素糖苷氧的质子化, 表明离子液体的酸性在纤维素转化为乙酰丙酸的过程中起着关键作用。
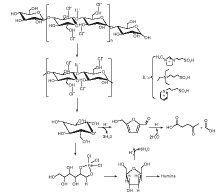
Brø nsted-Lewis双酸性离子液体催化纤维素转化生成乙酰丙酸的机理如图2所示。由图2可以看出, 纤维素经过三步反应转化生成乙酰丙酸。在第一步反应中, C1-与纤维素的羟基形成氢键, 然后H+与纤维素β -1, 4糖苷键结合, 纤维素被降解成葡萄糖单元; 在第二步反应中, 葡萄糖脱水生成5-羟甲基糠醛的反应途径有两种, 一种是葡萄糖在酸催化作用下脱水生成5-羟甲基糠醛, 另一种是葡萄糖先异构化为果糖, 然后由果糖脱水生成5-羟甲基糠醛。根据文献[20], 葡萄糖异构化为果糖是整个反应的速率控制步骤, 而Lewis酸可以促进葡萄糖的异构化; 在第三步反应中, 5-羟甲基糠醛在H+的作用下水解生成乙酰丙酸, 同时, 乙酰丙酸的生成过程中伴随着腐殖质的生成[21]。因此, Brø nsted-Lewis双酸性离子液体的协同催化作用不仅可以打破纤维素的氢键结构, 而且还可以提供足够的酸性位点促进乙酰丙酸的生成。
2.3.1 反应温度
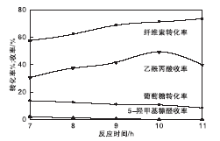
在纤维素用量0.50 g、[HO3S-(CH2)3-mim]Cl-FeCl3催化剂用量0.62 mmol、反应时间10 h条件下, 考察反应温度对乙酰丙酸收率和纤维素转化率的影响, 结果如图3所示。由图3可以看出, 反应温度对乙酰丙酸收率影响很大。反应温度低于180 ℃时, 纤维素转化率随着反应温度的升高明显增大, 乙酰丙酸收率逐渐增加, 中间产物葡萄糖和5-羟甲基糠醛收率逐渐减小。当反应温度达到180 ℃时, 纤维素转化率71.45%, 乙酰丙酸收率达到最高, 为49.47%, 中间体葡萄糖和5-羟甲基糠醛收率分别为10.6%、0。主要是因为随着反应温度升高, 反应体系的黏度降低, 传质速率增加, 反应速率随之增加, 有利于乙酰丙酸的生成[22]。当温度高于180 ℃时, 葡萄糖和5-羟甲基糠醛容易聚合成副产物, 过高的反应温度也促进乙酰丙酸分解为α 、β -当归内酯, 从而使乙酰丙酸收率下降[23]。
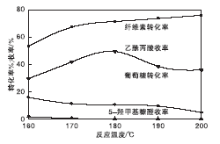 | 图3 反应温度对乙酰丙酸收率和纤维素转化率的影响Figure 3 Effects of reaction temperature on LA yield andcellulose conversion |
2.3.2 反应时间
在纤维素用量0.50 g、[HO3S-(CH2)3-mim]Cl-FeCl3催化剂用量0.62 mmol、反应温度180 ℃条件下, 考察反应时间对乙酰丙酸收率和纤维素转化率的影响, 结果如图4所示。由图4可以看出, 当反应时间低于10 h时, 随着反应时间增加, 纤维素转化率和乙酰丙酸收率不断增加; 反应时间10 h时, 乙酰丙酸收率最高, 为49.47%。结合图1可以看出, 在反应过程中葡萄糖会发生脱水反应, 生成的水会部分配位在催化剂表面, 导致反应体系的H+增加, 从而造成乙酰丙酸收率增加
2.3.3 催化剂用量
在纤维素用量0.50 g、反应温度180 ℃、反应时间10 h条件下, 考察[HO3S-(CH2)3-mim]Cl-FeCl3催化剂用量对乙酰丙酸收率和纤维素转化率的影响, 结果如图5所示。
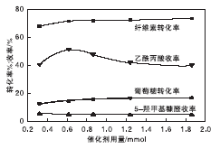 | 图5 催化剂用量对乙酰丙酸收率和纤维素转化率的影响Figure 5 Effects of the catalyst dosage on LA yield andcellulose conversion |
由图5可以看出, 当催化剂离子液体用量从0.32 mmol增加到0.62 mmol时, 纤维素转化率从61.00%增加到71.45%, 乙酰丙酸收率从30.11%增加到49.47%。这是因为随着催化剂用量的增加, 反应体系中的催化活性位点不断增加, 纤维素转化率和乙酰丙酸收率增加。当催化剂用量超过0.62 mmol, 纤维素转化率保持较平稳状态, 乙酰丙酸收率呈下降趋势, 这是由于催化剂的催化活性过高, 导致乙酰丙酸自身分解速率加剧。这意味着在该实验条件下有足够的催化位点促进纤维素转化为乙酰丙酸。
在纤维素用量0.50 g、 [HO3S-(CH2)3-mim]Cl-FeCl3催化剂用量0.62mmol、去离子水用量30 mL、反应温度180 ℃、反应时间10 h条件下, 考察催化剂重复使用次数对乙酰丙酸收率和纤维素转化率的影响如表2所示。由表2可以看出, [HO3S-(CH2)3-mim]Cl-FeCl3催化剂重复使用5次后, 乙酰丙酸收率仍大于44%, 表明Brø nsted-Lewis双酸性离子液体是一种稳定的、重复性高的催化剂。
| 表2 催化剂重复使用次数对乙酰丙酸收率的影响 Table 2 Effects of different reusability of catalyst on LA yield and cellulose conversion |
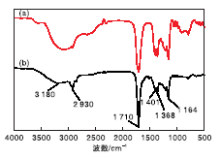
图6为离子液体使用前后的红外谱图。由图6可以看出, 1 215 cm-1和1 039 cm-1处的吸收峰分别是磺酸基团的不对称伸缩振动和对称伸缩振动, 相比之下, 使用后的离子液体在1 215 cm-1处有明显的变化。同时, 3 417 cm-1和3 095 cm-1处的吸收峰有明显变化, 为磺酸基团的氢键。这是因为磺酸基团的H+在催化过程会有微量流失。
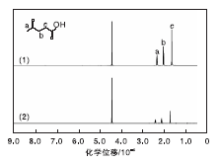
图7为乙酰丙酸的1H NMR谱图。由图7可见, 乙酰丙酸标准品和乙酰丙酸产品具有相同的特征峰。
图8为乙酰丙酸的红外谱图。由图8可以看出, 3 180 cm-1和2 930 cm-1处的吸收峰发生了明显的变化, 分别对应OH和C-H的伸缩振动, 可能是由醛和甲酸的反应引起的。相比之下, 1 710 cm-1处C 
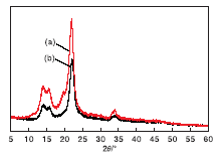
图9为纤维素和固体残余物的XRD图。
由图9可以看出, 反应后的固体残余物与纤维素具有相似的衍射峰(15.8° , 23.5° , 34.5° )[25, 26], 但是固体残余物的相对结晶指数(CrI=62.70%)低于纤维素的相对结晶指数(CrI=67.02%)。这是因为反应过程中产生的腐殖质覆盖在纤维素表面, 导致纤维素的结晶结构发生变化[27]。
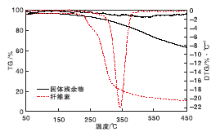
图10为纤维素和固体残余物的TG-DTG曲线。
纤维素的分解温度为(335~375) ℃, 由图10可见, 反应后固体残余物的分解温度为(337~472) ℃。据文献报道[28], 在(341~499) ℃出现的特征峰是固体腐殖质的特征峰。腐殖质在转化过程中会不断脱水, 从而导致固体腐殖质的热稳定性高于纤维素的热稳定性。
图11为纤维素和固体残余物的SEM照片。从图11可以看出, 纤维素在低倍数条件下呈现长条块状结构, 而在较高放大倍数下, 纤维素表面呈现紧密的片状结构。反应后, 固体残余物呈现松散的块状结构, 经放大后发现, 固体残余物表面呈粗糙并且无序的形态, 在边缘处有明显的球形颗粒。根据Ren H等[16]的报道, 固体腐殖质的特征形态为球形颗粒。结合图9~11可以表明, 在纤维素转化到乙酰丙酸的过程中伴随着腐殖质的生成。
(1) 考察了12种Brø nsted-Lewis双酸性离子液体对乙酰丙酸收率的影响, 同时探究了合成乙酰丙酸的最佳工艺条件:[HO3S-(CH2)3-mim]Cl-FeCl3(FeCl3物质的量分数为0.60)用量0.62 mmol, 纤维素用量0.50 g, 反应温度180 ℃、反应时间10 h, 去离子水30 mL。在最佳反应条件下, 纤维素转化率为71.45%, 葡萄糖、5-羟甲基糠醛和乙酰丙酸收率分别为10.60%、0和49.47%。
(2) [HO3S-(CH2)3-mim]Cl-FeCl3(FeCl3物质的量分数为0.60)重复使用5次后, 乙酰丙酸收率仍保持大于44%。结合FT-IR表征可以看出, 重复使用5次后的离子液体仍具有稳定的结构。
(3) 对固体残余物进行SEM、TG-DTG和XRD表征, 发现有腐殖质附着在未反应的纤维素表面, 使固体残余物的结晶指数下降, 热稳定性提高, 纤维素的原始形貌结构发生变化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|