作者简介:陈雷,1990年生,男,山东德州市人,在读硕士研究生,研究方向为光催化新材料。
采用超声辅助溶胶-凝胶法制备活化半焦负载B掺杂TiO2光催化剂,即B-TiO2/ASC。在相同实验条件下,分别在紫外和可见光下研究其对模拟烟气的光催化氧化脱硝性能。结果表明,在紫外和可见光下,B掺杂光催化剂的活性得到提高,在可见光下的活性增加更加显著,反应180 min后仍可保持80%以上的脱硝率。结合XRD和FT-IR分析,可以看出B以取代掺杂的方式存在于TiO2中并且导致TiO2表面缺陷。表面缺陷有助于光生载流子的分离,从而延长光生电子的寿命并增加参与光催化反应的光生电子数量,从而产生更多的羟基自由基氧化NO,最终提高光催化脱硝率。
B-doped TiO2 photocatalyst supported on activated semi-coke,namely B-TiO2/ASC,was prepared by ultrasonic-assisted sol-gel method.Under the same experimental conditions,photocatalytic activities for NO removal was studied under UV and visible light irradiation, respectively.The results showed that under UV and visible light irradiation,activity of B-doped catalysts was improved,activity under visible light irradiation increased more significantly, and NO removal efficiency could still maintained over 80% after 180 min reaction.X-ray diffraction and FT-IR spectra results indicated that B got into TiO2 lattice by substitution doping and caused TiO2 surface defects.Surface defects contributed to the separation of photogenerated carriers,thereby prolonged the lifetime of photo-generated electrons and increased the number of photo-generated electrons involved in photocatalytic reactions,generated more hydroxyl radicals to oxidize NO,and ultimately increased photocatalytic denitration efficiency.
近年来, NOx已成为我国主要空气污染物之一。严重影响人民群众的身体健康, 成为制约经济发展的瓶颈。“ 十三五” 规划明确提出各地区NOx综合治理规划。NOx的排放控制技术已成为亟需改进的国家战略性问题。
基于NOx对环境影响的控制技术引起广泛关注[1, 2]。目前, 研究较多的是采用氨作为还原剂的选择性催化还原法(SCR)[3, 4], 将NOx在高温下还原成N2, 其脱硝催化剂在工艺技术、生产设备及质量过程控制等方面要求非常高。催化氧化是一种更加环保节能的脱硝方法, 相关研究主要集中在吸附催化氧化上, 首先NOx吸附在催化剂表面, 然后被氧化为NO2, 最终以N
目前, 利用光催化技术消除NOx污染物的研究受到广泛关注, TiO2作为一种常用的半导体, 在光催化研究中应用广泛, 但量子效率低[12]和光谱响应窄[13]等缺点使其应用具有局限性。针对这些缺点, 研究人员进行了大量研究, 通过多种手段对TiO2的性能进行改进, 如贵金属沉积、掺杂及与其他材料复合等, 研究表明, 上述手段对提高TiO2的光催化能力均具有一定效果。
本文对TiO2进行非金属原子掺杂, 并将其负载到活性半焦上, 制备复合型掺杂TiO2光催化剂, 采用超声辅助溶胶-凝胶法分别制备不同掺杂比例的B-TiO2/ASC光催化剂。在相同实验条件下, 研究催化剂在紫外和可见光下的光催化氧化脱硝性能。并采用X射线衍射、傅里叶红外光谱、紫外-可见吸收光谱和荧光光谱等对催化剂的形貌和结构进行表征。
钛酸正丁酯, 化学纯, 国药集团化学试剂有限公司; 无水乙醇, 分析纯, 天津博迪化工股份有限公司; 硼酸, 分析纯, 莱阳市康德化工有限公司; 冰醋酸、硝酸, 分析纯, 国药集团化学试剂有限公司; 氮气, 99.99%。
半焦和质量分数45%的硝酸溶液以体积比1∶ 1.2混合, 75 ℃下冷凝回流2 h, 蒸馏水洗涤至接近中性后在110 ℃下干燥, N2保护下将管式炉中的温度升高至700 ℃, 再改为10%水蒸汽持续2 h, 最后用N2保护降至室温获得活化半焦, 备用。
在25 ℃的超声条件下, 将8 mL钛酸正丁酯滴加到20 mL无水乙醇中; 硼酸(分别取1.422 1 g, 0.355 5 g, 0.142 2 g, 0.071 1 g, 0.035 6 g)与10 mL乙醇、10 mL冰醋酸和5 mL蒸馏水混合并滴加到上述溶液中, 得均匀透明的溶胶液。
将50 mL活化半焦浸渍到上述溶胶液中, 室温放置24 h, 然后在110 ℃下干燥过夜。最后N2保护下500 ℃焙烧1 h, 得Ti与B物质的量比分别为1∶ 1、4∶ 1、10∶ 1、20∶ 1和40∶ 1的B-TiO2/ASC光催化脱硝剂。
催化剂晶体结构在德国布鲁克公司D8 Advance X射线衍射仪上进行, 工作电压40 kV, 工作电流40 mA, CuKα , 扫描速率6° · min-1, 扫描步长0.02° , 扫描范围10° ~70° 。
催化剂红外光谱采用美国赛默飞世尔公司Nicolet 6700 傅立叶红外光谱仪测试, 光谱检测范围(4 000~400) cm-1。
使用日本日立公司U-4100光谱仪测试催化剂的UV-Vis吸收光谱, 检测波长范围(200~700) nm。
催化剂荧光光谱采用HORIBA Jobin Yvon/Fluoro Max 4荧光光谱仪测试。
采用模拟烟气作为污染源, 考察复合光催化剂对NO的光催化氧化去除能力。光催化氧化去除NO在独立设计的光催化反应器中进行。反应器外径和内径之差为25 mm, 反应器内管为壁厚2 mm的可拆卸石英管。反应器外层有一个10 mm宽的夹层, 内装循环水以保持恒定的反应温度。反应器底部是厚度为3 mm的石英布气板, 以使进入反应器的气体混合物均匀的进入催化剂床层。实验装置如图1所示。
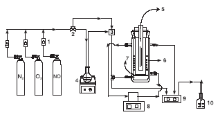 | 图1 光催化反应实验装置 1.转子流量计; 2.三通阀; 3.气体混合器; 4.增湿器; 5.紫外/可见灯; 6.催化剂; 7.石英布气板; 8.循环泵; 9.烟气分析仪; 10.尾气吸收Figure 1 Apparatus for photocatalytic removal of NO |
光催化反应条件:NO浓度(400~500) mg· m-3, O2为5%, 水蒸汽含量8%, 平衡气为N2, 空速600 h-1。催化剂装填量50 mL, 底部填充50 mL石英砂。循环水温度为90 ℃, 实际床层温度测得为100 ℃。使用主波长254 nm, 功率18 W的低压汞灯作为紫外光源, 使用功率35 W的氙灯作为可见光源。开始反应前, 用烟气分析仪检测混合气中NO的初始浓度。然后每隔15 min测量NO浓度, 并在210 min内测试催化剂的光催化脱硝效果。
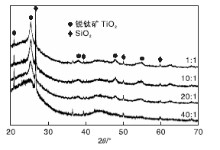
图2是不同掺杂比例的B-TiO2/ASC催化剂的XRD图。
从图2可以看出, 在催化剂中掺杂B不会改变锐钛矿TiO2的晶型结构, 但能改变晶型的完善程度。随着B掺杂量的增加, TiO2主要以非晶态存在。同时看到B3+的粒径小于Ti4+, 掺杂B可引起TiO2表面缺陷。可能是B以取代掺杂的形式存在于TiO2晶格中, 形成有利于光催化的氧空位。Zhao W等[14]研究表明, B以取代掺杂的形式存在于TiO2中; Grey I E等[15]研究表明, B以间隙掺杂的形式存在于TiO2中。
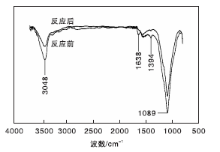
图3是n(Ti)∶ n(B)=10∶ 1的B-TiO2/ASC催化剂紫外光下反应前后红外光谱图。
从图3可以看出, 反应前在3 408 cm-1处存在O-H峰, 反应后在此处的羟基峰变强, 可能是由于催化剂表面有吸附水存在所致; 1 638 cm-1和1 394 cm-1处是硝基反对称与对称伸缩振动峰, 是NO被光催化氧化后的产物; 1 089 cm-1处主要是醚类官能团, 也可能是Ti— O— C键。
图4是不同掺杂比例的B-TiO2/ASC催化剂紫外-可见吸收光谱图。
从图4可以看出, 与TiO2/ASC催化剂相比, B-TiO2/ASC催化剂的吸收发生了红移, 这与Zhao W等[14]实验结果相符, 与Chen D等[16]的实验结果相反。杨可松等[17]研究表明, 当B以替代掺杂的方式存在TiO2中时, 会使TiO2的吸收出现红移; 而当B以间隙掺杂方式存在TiO2中时, 则会使TiO2的吸收出现蓝移。光吸收出现红移说明催化剂对可见光的响应增强, 对应的带隙宽度变窄, 在低能量的激发光下就可以产生激发电子, 产生更多的载流子, 促进光催化反应的进行。
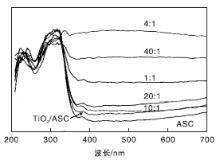 | 图4 不同掺杂比例的B-TiO2/ASC催化剂紫外-可见吸收光谱图Figure 4 UV-Vis spectra of B-TiO2/ASC catalyst with different loading amount of B |
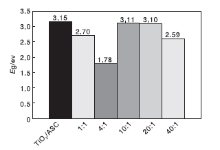
根据Kubellka-Munk公式[18]计算B-TiO2/ASC催化剂各掺杂比的带隙宽度。B-TiO2/ASC的带隙宽度均比TiO2/ASC的小, 实验结果表明, B掺杂可以降低TiO2/ASC的带隙, 最大值可达1.37 eV。结合图5分析, 带隙宽度的变窄是由较大的晶粒所致。Zhao W等[14]实验结果表明, B掺杂后可以降低TiO2的禁带宽度0.25 eV。带隙宽度变窄是由于掺杂B后在原来的带隙间形成一个或多个新的能级, 当价带电子跃迁到导带时需要的能量降低, 相同能量的激发光激发时会产生更多的电子(见公式1), 结果产生更多的载流子, 导致催化剂光催化活性增强。
根据费米-狄拉克统计简化[19, 20]得B-TiO2/ASC催化剂表面可激发电子数N和TiO2/ASC催化剂表面可激发电子数N0的比值为:
n=N/N0≈
式中, k为玻尔兹曼常数, T为温度。
根据公式(1)计算不同掺杂比例下的n值, 反应温度T=373.15 K, 并列入表1中。
| 表1 不同n(Ti)∶ n(B)下B-TiO2/ASC与TiO2/ASC可供激发电子数之比 Table 1 Ratio of electrons to be excited between B-TiO2/ASC with different n(Ti)∶ n(B) and TiO2/ASC |
理论上, 所有Ti与B比可以增加TiO2/ASC催化剂上光生载流子数量, 进而提高其光催化活性。然而, n值是在简化条件仅为理论数值, 并不代表实际光催化过程中产生的光生载流子数量的比例, 具体情况需结合光催化活性进行分析。并非所有可被激发的电子都被激发, 并且被激发的电子不完全参与目标反应, 因为激发电子数量增加时光生载流子复合概率增加, 同时除了部分光生电子热辐射外, 部分光生电子也会引起副反应的发生。因此, 光催化活性增加的倍数并不和可激发电子增加的倍数相同。
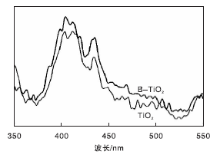
图6是TiO2与B-TiO2[n(Ti)∶ n(B)=10∶ 1]的荧光光谱图。激发波长为380 nm, 最佳发射波长大于400 nm, 比激发波长长, 即产生斯托克斯位移。
从图6可以看出, TiO2粉末在(400~420) nm处具有强峰, 表明TiO2在该光谱区域中具有很高的光生电子和空穴复合的可能性。B-TiO2的峰值强于TiO2的峰值, 这是因为B-TiO2表面的氧空位和表面缺陷的数量增多, 随着激发电子的数量增加, 光生载流子复合的概率增加。
图7显示了在紫外和可见光下不同掺杂比的B-TiO2/ASC催化剂的光催化脱硝效果。从图7可以看出, 在紫外光和可见光条件下, 随着B掺杂量的减少, 催化剂脱硝作用均先增大后减小。n(Ti)∶ n(B)=10∶ 1时, 紫外光下B-TiO2/ASC的光催化氧化脱硝效果较好, 180 min后脱硝率仍达80.63%, 可见光下180 min后的脱硝率仍高于75%。n(Ti)∶ n(B)=4∶ 1、10∶ 1、20∶ 1、40∶ 1时, 两种条件下的脱硝率均呈现缓慢下降的趋势, 说明适当比例的掺杂B不仅能提高催化剂的光催化氧化脱硝作用, 而且可以延长其使用寿命。当n(Ti)∶ n(B)=1∶ 1时, 两种条件下脱硝率都最低, 可能是H3BO3干扰了TiO2晶体的生成, 并阻塞了半焦的微孔道, 导致催化性能降低。实验结果表明, 适当比例B掺杂后催化剂催化效果都有明显改善, 且在可见光下比在紫外光下的催化效果要好, n(Ti)∶ n(B)=20∶ 1可见光下反应结束时的脱硝率高于80%。表明掺杂B可以提高催化剂的可见光催化活性。
 | 图7 紫外光和可见光下B-TiO2/ASC催化剂光催化脱硝效果Figure 7 De-NO activities of B-TiO2/ASC catalyst under UV and visible light irradiation |
从表征结果推测, B以替代掺杂的形式存在于TiO2中, B3+离子半径为(23× 10-12 m)小于Ti4+离子半径(74.5× 10-12 m)这导致TiO2的表面缺陷, 每替换两个Ti4+就会产生一个氧空位, 都有利于光生载流子的分离, 从而延长光生电子的寿命并使更多的光生电子参与光催化反应[21], 结果更多的· OH氧化NO并最终增加光催化脱硝率。当B掺杂量过高时, 会阻碍TiO2晶体的产生不利于光催化脱硝。
不同n(Ti)∶ n(B)下的n值与在紫外和可见光下反应180 min的光催化脱硝率见表2。
| 表2 不同n(Ti)∶ n(B)下的n值与光催化脱硝率 Table 2 NO conversion and n value under different n(Ti)∶ n(B) |
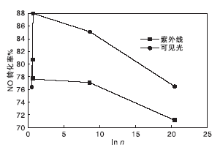
根据表2中数据, 用lnn和NO转化率作图, 结果如图8所示。当n(Ti)∶ n(B)=1∶ 1时, 催化剂中的TiO2是无定形的, 所以删除这个样品的参数。
从图8可以看出, B修饰的TiO2/ASC紫外光的能级阈值E0UV在lnn=0.62时出现, E0UV=3.11 eV, 而可见光下的能级阈值E0Vis出现在lnn=0.77时, 对应的E0Vis=3.10 eV。在紫外光下Eg< E0Vis, 光催化脱硝率随着lnn的增加而降低, 这是因为非金属B以取代掺杂的方式进入TiO2晶体, 产生氧空位, 这对催化剂表面吸附氧不利, 因此B-TiO2/ASC要发生光催化反应就必须用高能量的光生电子来捕获游离氧, 禁带太小, 氧化-还原电位太小不足以氧化NO, 因此光催化活性降低; 在可见光下, 当Eg> E0Vis时, 光催化脱硝率随着lnn的增大而升高; 当Eg< E0Vis时, 光催化脱硝率随着lnn的增加而降低。
(1) 采用超声辅助溶胶-凝胶法制备了一种活化半焦负载B掺杂TiO2的光催化剂。XRD表明B掺杂后TiO2结晶度发生变化, B以取代掺杂的形式进入TiO2晶格中, 使晶格发生畸变, 引起在UV-Vis谱图中光吸收发生红移, 得出B掺杂使TiO2/ASC禁带宽度变小。B-TiO2/ASC催化剂在紫外光下的能级阈值E0UV=3.11 eV, 在可见光下的能级阈值E0Vis=3.10 eV。
(2) 通过对催化剂光催化氧化脱硝性能的评估, B掺杂提高了催化剂在紫外和可见光下的活性, 其中, 可见光下增加更为明显, 反应结束时脱硝率仍大于80%。B-TiO2/ASC催化剂有很好的脱硝效果, 具有一定的工业应用价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|