作者简介:张英华,女,1992年生,山西省平遥县人,在读硕士研究生,研究方向为含氧煤层气脱氧催化剂的研制。
以金属硝酸盐为前驱物,乙二胺四乙酸为助剂,采用正交实验设计和浸渍法制备Cu-Ni、Cu-Fe和Ni-Fe系列TiO2基双金属氧化物催化剂,通过XRD和H2-TPR进行表征,评价其氧化还原性能。结果表明,活性组分为Cu和Fe、物质的量比为0.2:0.2、pH为8.0和400 ℃焙烧的5#催化剂具有优良的氧化还原性能,起始还原温度148 ℃条件下,耗氢量达80.72 mmol·g-1。活性组分、物质的量比、pH值和焙烧温度等催化剂制备参数影响氧化还原反应的难易(起始还原温度)和强弱(耗氢量),Cu和Fe物质的量比为0.2:0.2的催化剂由于协同效应具有最低的起始还原温度和很高的耗氢量。较低物质的量比含Ni活性组分的催化剂由于形成复合金属氧化物固溶体而难以在较低温度被还原,中性或碱性条件下通过氢氧化物脱水生成金属氧化物有助于提高催化剂的耗氢量,400 ℃足以形成适宜的晶型以提高催化剂氧化还原性能。
With metal nitrate as precursor and EDTA as additive agent,TiO2-supported bimetallic oxide catalysts, Cu-Ni, Cu-Fe and Ni-Fe, were prepared by orthogonal design and impregnation method, and characterized by XRD and H2-TPR.The results indicated that the No.5 catalyst obtained at the optimal condition of Cu-Fe 0.2:0.2 mole ratio,8.0 pH value and 400 ℃ calcination temperatureshowedthe best redox activity.When initial reduction temperature was 148 ℃, hydrogen consumption was 80.72mmol·g-1.The catalysts’ redox difficulty(initial reduction temperature) and intensity(hydrogen consumption) were affected bypreparation parameters including active ingredient,mole ratio,pH value and calcination temperature.Catalyst with Cu-Fe molar ratio of 0.2:0.2 showed the lowest initial reduction temperature and the higher hydrogen consumption due to the synergistic effect.Ni-containing catalysts with lower molar ratio,tending toform complex metal oxide,were difficult to be reduced at lower temperature.Metal oxides formed through hydroxide dehydration under neutral or alkaline conditions were beneficial to increase the hydrogen consumption.Calcinationof 400 ℃ was sufficient to form the crystal phase required for the reaction with higher redox activity.
煤层气作为一种非常规天然气, 在能源结构中占有非常重要地位[1], 而煤层气中空气或氧气的存在导致严重的安全问题[2], 制约其综合利用。煤层气脱氧一般采用低温精馏[3]、变压吸附[4]和膜分离法[5]等技术, 在其升温或加压过程中会导致CH4爆炸极限变宽[6]而易引起爆炸。而催化燃烧脱氧技术以其很高的脱氧效率和超低的NOx、CO等污染物排放量[7, 8], 成为煤层气脱氧的研究热点。
煤层气燃烧脱氧常用的催化剂可分为两大类, 一类是贵金属催化剂, 如Rh、Pt、Pd等, 活性高和选择性好[9, 10, 11], 但耐硫与耐热性差且价格昂贵[12]; 另一类是过渡金属氧化物催化剂, 如Mn、Fe、Co等, 价格低廉和耐硫性好, 但活性和选择性较差[13]。然而同为非贵过渡金属的CuO在甲烷催化燃烧反应中表现出优良的催化性能, Á guila G等[14]考察了载体对CuO催化燃烧甲烷的影响, 其活性顺序为:CuO/ZrO2> CuO/Al2O3> CuO/SiO2; Yin F等[15]添加Ce助剂与Cu形成固溶体, 通过增加Cu物种的分散度和改变各自的氧化还原性能, 提高了催化活性; Marion M C等[16]发现, CuO负载于Al2O3载体上制得的催化剂在甲烷催化燃烧反应中的催化活性高于ZnAl2O4载体。
由于TiO2载体与活性金属氧化物之间具有强相互作用[17], 加之表面酸性的可调节性而成为一种重要的催化剂载体, 并广泛应用于能源和环保等领域[18, 19, 20]。本文以TiO2为载体、采用浸渍法分别制备以Cu-Ni、Cu-Fe和Ni-Fe为活性组分的双金属氧化物催化剂, 通过XRD和H2-TPR进行表征, 考察活性组分、物质的量比、pH值和焙烧温度等制备参数对TiO2基双金属氧化物催化剂氧化还原性能的影响规律, 以期为煤层气燃烧脱氧催化剂的遴选提供依据。
TiO2载体采用溶胶-凝胶常压干燥法制备, 过程参见文献[21]; 双金属氧化物TiO2基催化剂采用表1四因素三水平正交实验设计, 以Ni(NO3)2· 6H2O、Cu(NO3)2· 3H2O、Fe(NO3)3· 9H2O为前驱物, 分别将设定量的前驱物溶于配制好的乙二胺四乙酸(EDTA)氨水溶液中[按n(EDTA): n(金属离子)=1: 1称取EDTA溶于氨水中, 配成约1 mol· L-1溶液], 用氨水调节至设定pH值, 再将10 g TiO2载体浸渍于上述溶液中, 充分搅拌后室温静置30 min, 160 ℃干燥8 h, 马弗炉于设定温度焙烧3 h, 得到双金属氧化物TiO2基催化剂。
| 表1 正交实验设计的水平因素表 Table 1 Value of each factor of orthogonal experimental design |
H2-TPR采用美国麦克仪器公司ChemiSorb2720化学吸附仪测试, 催化剂在300 ℃下用Ar气预处理2 h, 待基线平稳后以30 mL· min-1通入10%H2-Ar混合气, 以升温速率5 ℃· min-1程序升温至800 ℃。
XRD采用日本理学株式会社Ku/MiniFlex 600型全自动X射线衍射仪表征, 工作电压40 kV, Cu靶, λ =0.154 2 nm, 扫描范围5° ~80° 。
双金属氧化物TiO2基催化剂的XRD图如图1所示。
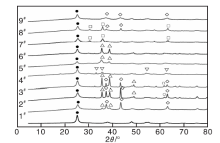 | 图1 双金属氧化物TiO2基催化剂的XRD图Figure 1 XRD patterns of TiO2-supported bimetalllic oxide catalysts lTiO2(anatase); rCuO; ¯ NiO; sFe2O3; ¡ Ni0.9Cu0.1O; ¨ NiFe2O4 |
由图1可以看出, 25.303° 、37.792° 、48.035° 、55.059° 和62.683° 分别对应于锐钛矿相TiO2的(101)、(004)、(200)、(211)和(204)晶面(PDF#65-5714), 表明所有催化剂均显示锐钛矿相TiO2的特征峰, 锐钛矿相较金红石相TiO2具有较大的比表面积和较好的晶体结构, 有利于活性组分在其表面良好分散[22, 23, 24], 使其具有较高的煤层气脱氧性能。对Cu-Ni/TiO2催化剂(1#、2#和3#), 35.494° 、38.890° 和48.658° 分别对应CuO的(-111)、(200)和(-202) 晶面(PDF#80-1916); 37.319° 、43.362° 和62.995° 分别对应NiO的(111)、(200)和(220) 晶面(PDF#75-0197); 随着Cu与Ni物质的量比和焙烧温度增加, 1#、2#和3#催化剂NiO特征峰逐渐减弱, CuO特征峰逐渐增强, 表明其晶化程度与高负载量和高焙烧温度呈正对应。2#和3#催化剂在62.801° 出现Ni0.9Cu0.1O的(220)晶面特征峰(PDF#78-0645), 表明随着温度升高, 形成了铜镍复合氧化物固溶体。对于Cu-Fe/TiO2催化剂(4#、5#和6#), 33.117° 、35.611° 、54.002° 和62.385° 分别对应Fe2O3的(104)、(110)、(116)和(214) 晶面(PDF#72-0469); 4#催化剂未出现CuO的特征峰, 显然与其较低的负载量有关, 同时也表明在载体上分散较均匀; 随着Cu与Fe物质的量比增加(5#和6#), CuO的特征峰出现并增强, 而Fe2O3的特征峰不明显, 与Fe2O3含量减小有关, 也与较低的焙烧温度有关。对于Ni-Fe/TiO2催化剂(7#、8#和9#), 7#和8#催化剂在30.294° 、35.685° 和63.013° 出现明显的特征峰, 归属为NiO和Fe2O3形成NiFe2O4尖晶石的特征衍射峰[25], 且8#催化剂的特征峰明显高于7#催化剂, 可能与其较高的焙烧温度有关; 7#催化剂未检测出NiO特征峰, 与其低的NiO含量有关; 9#催化剂只出现NiO的特征峰, 未检测出Fe2O3和NiFe2O4特征峰, 一方面可能是由于Fe含量较少, 均匀分散在催化剂表面, 另一方面与较低的焙烧温度不容易形成镍铁尖晶石有关。
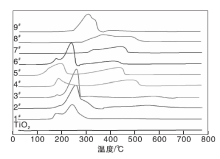
图2为双金属氧化物TiO2基催化剂的H2-TPR谱图。
由图2可以看出, 对Cu-Ni/TiO2催化剂而言, 1#、2#和3#催化剂在约180 ℃的低温还原峰对应于CuO的还原。Dow W P等[26]研究氧化铜负载在氧化钇作为稳定剂的氧化锆载体上的还原过程, 将这个低温还原峰归结于落在载体表面氧空缺位上与铜连接较弱的氧化铜上的氧离子的还原耗氢蜂; 故本实验中双金属催化剂上的该低温还原峰可类似归因于处在镍氧化物氧空缺位上与铜连接较弱的邻近氧化铜的氧离子的还原耗氢峰; 约250 ℃的还原峰则是CuO和NiO还原的叠加, 随着Cu与Ni物质的量比增加, 耗氢量增大; Cu与Ni物质的量比为0.2: 0.2时(2#催化剂)耗氢量最大, 可能是CuO和NiO存在协同效应, 550 ℃高温区出现的还原峰归因于NiO和CuO形成的复合氧化物Ni0.9Cu0.1O固溶体的还原, 这从XRD图也可以得到佐证; 从1#到3#催化剂的还原峰有向高温方向移动的趋势, 可能与焙烧温度的提高有关。对Cu-Fe/TiO2催化剂而言, 260 ℃以前的低温还原峰为CuO的还原峰, 约450 ℃的高温还原峰对应于Fe2O3的还原, 随着Cu与Ni物质的量比增加, 低温耗氢量迅速增长, 而高温耗氢量逐步下降, 在Cu与Ni物质的量比为0.2: 0.2时(5#催化剂)达到峰值80.72 mmol· g-1, 同时Fe2O3还原峰向低温移动, 表明同样因协同效应Cu促进Fe的还原, 从而提高催化剂的氧化还原性能。对Ni-Fe/TiO2催化剂而言, 350 ℃的还原峰对应于NiO的还原, 约470 ℃的高温还原峰则为NiFe2O4→ NiFe2O4-δ 的还原[27, 28]; 7#催化剂主要是NiFe2O4→ NiFe2O4-δ 的还原, 9#催化剂主要为NiO的还原, 而8#催化剂兼有二者的还原, 在所有催化剂中, 7#和8#催化剂的结果最差, 表明镍铁尖晶石无助于催化剂氧化还原性能的提高(参见图1)。
对煤层气燃烧脱氧而言, 期望催化剂能在较低温度下具有较高的催化燃烧活性, 为此将起始还原温度和耗氢量作为指标以考察催化剂的氧化还原性能, 起始还原温度衡量催化剂氧化还原的难易, 耗氢量衡量催化剂氧化还原的强弱, 双金属氧化物TiO2基催化剂的起始还原温度和耗氢量列于表2。
| 表2 双金属氧化物TiO2基催化剂的起始还原温度和耗氢量 Table 2 Initial reduction temperature and hydrogen consumption of TiO2-supported bimetallic oxide catalysts |
将起始还原温度和耗氢量分别按单指标进行正交分析, 结果列于表3, 其中Ki为各因素同一水平之和, ki为各因素同一水平的平均值, R为各因素的极差。
| 表3 以起始还原温度和耗氢量为指标的正交分析 Table 3 Orthogonal analysis based on initial reduction temperature and hydrogen consumption |
各因素水平的最优组合采用综合平衡法确定[29], 根据起始还原温度和耗氢量两项指标正交分析的因素主次和水平优劣综合考虑, 得到最优因素水平组合。由表3可知, 活性组分(因素A)在起始还原温度中是主要因素, 按该指标要求定因素A的2水平为优水平, 即活性组分为Cu和Fe; 物质的量比(因素B)在耗氢量中是主要因素, 按该指标要求定因素B的2水平为优水平, 即物质的量比为0.2: 0.2; pH值(因素C)在耗氢量和起始还原温度中的影响相同, 在这两项指标中因素C的 3水平均为优水平, 即pH值为8.0; 焙烧温度(因素D)在起始还原温度中的影响大于耗氢量, 按该指标要求定因素D的1水平为优水平, 即焙烧温度为400 ℃。这样整体最优因素水平组合为A2B2C3D1, 即负载成分为Cu和Fe, 物质的量比为0.2: 0.2, pH值为8.0, 焙烧温度为400 ℃, 即最优因素水平组合为5#催化剂, 其起始还原温度最低, 为148 ℃, 耗氢量略低于2#催化剂, 为80.72 mmol· g-1。
2.3.1 活性组分
图3为活性组分对催化剂起始还原温度和耗氢量的影响。
 | 图3 活性组分对催化剂起始还原温度和耗氢量的影响Figure 3 Effect of active composition on initial reduction temperature and hydrogen consumption of catalysts |
由图3可以看出, Cu-Fe/TiO2催化剂起始还原温度较Cu-Ni/TiO2催化剂低, 表明Cu-Fe组合有利于催化剂在较低温度下被还原, 与H2-TPR结果一致, Cu-Ni/TiO2催化剂还原峰相较Cu-Fe/TiO2催化剂向低温区略有移动(相差6.77 ℃, 表3); 而Ni-Fe/TiO2催化剂的起始还原温度则远远高于前两者(相较Cu-Fe/TiO2高157 ℃, 表3), 高的起始还原温度可能是由于Fe和Ni之间形成铁镍尖晶石固溶体, 从而不易在低温下被还原。就耗氢量而言, Cu-Fe/TiO2催化剂和Cu-Ni/TiO2催化剂耗氢量变化趋势相近(前者高于后者6.67 mmol· g-1, 表3), 而Ni-Fe/TiO2催化剂的耗氢量明显低于前两者(相较Cu-Fe/TiO2低20.76 mmol· g-1, 表3), 表明活性组分中Cu起主要作用, 可以大幅提高催化剂的耗氢量, 即有利于提高催化剂的氧化还原性能。综合考虑起始还原温度和耗氢量, 以Cu-Fe为活性组分更为适宜。
催化剂的氧化还原性能与活性组分的性质密切相关, H2-TPR结果揭示了活性组分金属氧化物被氢气还原成金属的同时氢气被金属氧化物晶格氧氧化成水的难易和强弱程度, Cu、Ni和Fe的外围电子排布分别为3d104s1、3d84s2和3d64s2, 显然Cu更容易得失电子, 实验也表明含有Cu的活性组分组合使催化剂起始还原温度显著降低。
Cu系催化剂在甲烷的催化燃烧中表现出优良的催化性能。复合氧化物催化剂上煤层气燃烧脱氧被认为遵循E-R机理, 存在表面吸附氧和晶格氧两种活性氧物种[30], 较低温度时表面吸附氧与甲烷结合起氧化作用, 较高温度时晶格氧起作用, 在晶格中存在不同价态不同种类的金属离子可迁移氧离子, 催化剂晶格氧与气相氧通过Marsvan Krevelen氧化还原循环完成与甲烷的反应[31]。
本实验H2-TPR测试中预先在300 ℃用氩气吹扫2 h, 基本可排除表面吸附氧, 因而耗氢量主要与催化剂的晶格氧相关, 显然晶格氧与活性组分金属之间M-O键的强弱决定着催化剂的氧化还原性能。
2.3.2 物质的量比
图4为物质的量比对催化剂起始还原温度和耗氢量的影响。
 | 图4 物质的量比对催化剂起始还原温度和耗氢量的影响Figure 4 Effect of different mole ratio on initial reduction temperature and hydrogen consumption of catalysts |
由图4可见, 物质的量比增大, Cu-Ni/TiO2、Cu-Fe/TiO2和Ni-Fe/TiO2催化剂的起始还原温度总体趋势上升, 唯一例外是物质的量比为0.2: 0.2时, Cu-Fe/TiO2催化剂的起始还原温度出现谷值, 为最低148 ℃; 就耗氢量而言, 随着物质的量比增大, Cu-Ni/TiO2和Cu-Fe/TiO2催化剂的耗氢量出现峰值, 而Ni-Fe/TiO2催化剂的耗氢量呈上升趋势, 物质的量比为0.2: 0.2时, 前两者相差不大, 仅0.49 mmol· g-1, 与后者相差悬殊, 约40 mmol· g-1。综合考虑起始还原温度和耗氢量, 物质的量比为0.2: 0.2有助于提高催化剂的氧化还原性能。
物质的量比为0.2: 0.2实质上反映活性组分之间的相互作用。一方面, 对含有Ni的活性组分组合, 当Ni的物质的量比小于0.3时(2#、3#、7#和8#催化剂), 与Cu或Fe均容易形成复合金属氧化物固溶体, XRD图上分别出现Ni0.9Cu0.1O或NiFe2O4的特征峰[25], 从而不利于在较低温度下被还原; 对Cu-Fe/TiO2催化剂, 无论何种Cu与Fe物质的量比均无新的物质生成; 另一方面, 对特定的活性组分组合, 适宜的物质的量比会增强双金属活性位间的协同催化作用[32], 如Cu-Fe活性组分组合在物质的量比为0.2: 0.2时, 具有最低的起始还原温度和很高的耗氢量。
2.3.3 pH值
pH值对催化剂起始还原温度和耗氢量的影响如图5所示。
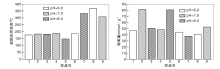 | 图5 pH值对催化剂起始还原温度和耗氢量的影响Figure 5 Effect of pH value on initial reduction temperature and hydrogen consumption of catalysts |
由图5可以看出, 同一类活性组分组合催化剂, 不同pH值对起始还原温度均无显著影响, Cu-Ni/TiO2、Cu-Fe/TiO2和Ni-Fe/TiO2催化剂的起始还原温度分别约180 ℃、170 ℃和330 ℃; 就耗氢量而言, pH值为6.0的酸性条件下耗氢量很小, pH值为7.0或8.0的中性或碱性条件下耗氢量较大, 比酸性条件约高150 mmol· g-1。综合考虑起始还原温度和耗氢量, pH值以8.0的碱性条件为宜。
pH值实质上反映的是制备过程中酸碱环境的不同导致活性组分金属氧化物形成机制的不同[33], 酸性条件下浸渍液始终以金属硝酸盐的形式存在, 焙烧时硝酸盐分解得到金属氧化物, 中性尤其是碱性条件下金属硝酸盐向氢氧化物转化, 同时硝酸根与氨水形成硝酸铵, 焙烧时氢氧化物脱水得到金属氧化物, 同时硝酸铵分解释放。实际上单纯通过氨水的调变无法达到设定的pH值, 随着氨水的加入, 浸渍液因发生沉淀反应而逐渐浑浊, 从而难以制备均匀的样品; 实验中通过添加乙二胺四乙酸与金属离子形成配位化合物以阻止其形成氢氧化物沉淀, 再用氨水调节pH值, 在焙烧过程中配位化合物进行分解或氧化反应与氨水一起脱除而不会带入杂质, 同时氨水也有可能作为配体参与配位化合物的形成[34]。
2.3.4 焙烧温度
焙烧温度对催化剂起始还原温度和耗氢量的影响如图6所示。
 | 图6 焙烧温度对催化剂起始还原温度和耗氢量的影响Figure 6 Effect of calcination temperature on initial reduction temperature and hydrogen consumption of catalysts |
由图6可以看出, 随着焙烧温度升高, 不同活性组分组合的催化剂的起始还原温度整体呈上升趋势(5#催化剂略低), 表明较低的焙烧温度有助于催化剂在较低的温度下被还原; 就耗氢量而言, 焙烧温度500 ℃和600 ℃时, 不同活性组分组合的催化剂的耗氢量逐渐降低, 而在400 ℃焙烧温度Cu-Fe/TiO2催化剂则出现峰值, 表明较低的焙烧温度同样有助于耗氢量的提升, 唯一例外是2#催化剂的大耗氢量, 可能是由于物质的量比为0.2: 02的Cu-Ni协同效应所致。综合考虑起始还原温度和耗氢量, 焙烧温度400 ℃有利于提升催化剂的氧化还原性能。
焙烧处理是为了得到适宜的催化剂活性组分晶体结构, 同时脱除制备过程中引入的杂质, 对比图1可以看出, 所有催化剂在400 ℃及以上焙烧温度均已形成不同晶体结构, 而500 ℃及以上焙烧温度则使含Ni活性组分组合催化剂形成复合金属氧化物固溶体(2#、3#、7#和8#催化剂)。此外就催化剂的制备成本而言, 较低的温度意味着较低的能源消耗, 与此同时随着焙烧温度的升高, 催化剂的活性组分有可能烧结, 导致比表面积下降和表面活性位数量减少[21], 从而使催化剂活性降低, 而400 ℃焙烧温度足以形成适宜的晶体结构以满足催化反应所需的氧化还原性能。
(1) 以Ni、Cu、Fe的金属硝酸盐为前驱物、乙二胺四乙酸为助剂, 采用正交实验设计和浸渍法制备系列TiO2基双金属氧化物负载型催化剂。以起始还原温度和耗氢量为指标进行正交分析, 得到最优组合:活性组分为Cu和Fe, 物质的量比为0.2: 0.2, pH值为8.0, 焙烧温度400 ℃, 即5#为最优催化剂, 其起始还原温度为148 ℃, 耗氢量80.72 mmol· g-1, 在本实验所有催化剂中氧化还原性能最佳。
(2) 活性组分的性质影响催化剂的起始还原温度, Cu-Fe活性组分组合由于协同效应有助于催化剂降低起始还原温度和提高耗氢量; 物质的量比实质上反映的是活性组分之间的相互作用, 较低物质的量比含Ni活性组分组合容易形成复合金属氧化物固溶体, 不利于在较低温度下被还原; pH值反映不同酸碱环境双金属氧化物的不同形成机制, 中性和碱性条件通过氢氧化物脱水生成金属氧化物有助于提高耗氢量; 焙烧处理旨在获得适宜的催化剂活性组分晶体结构并脱除杂质, 400 ℃足以形成适宜的晶型以满足催化反应所需的氧化还原性能。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|