作者简介:潘喜强,1984年生,男,湖北省十堰市人,博士,研究方向为能源与环境催化。
氯化氢催化氧化制氯气具有高效率、低能耗、环境友好等优点,一直是研究的热点。首先采用浸渍法制备RuO2/TiO2催化剂,并通过催化活性评价和H2-TPR表征优化Ru的负载量。然后制备Ce、Mn、La、Zr、Co等氧化物修饰的MOx-TiO2(M=Ce、Mn、La、Zr、Co)载体及RuO2/MOx-TiO2催化剂,考察不同修饰物对催化剂氯化氢氧化性能的影响。结果表明,采用该型号TiO2载体时最佳负载质量分数为2%~3%;MOx-TiO2载体中MOx修饰物均呈高分散状态,La、Zr、Ce等氧化物修饰后,TiO2晶粒尺寸增大,其中Zr、Mn、Co等氧化物掺杂进入TiO2晶格。Ce和Zr氧化物修饰可以提高RuO2/TiO2催化剂催化活性,Mn、Co、La等氧化物修饰对活性有不利影响。Mn、Co氧化物修饰可以降低反应活化能,所以这两种氧化物修饰的催化剂催化活性较低是由指前因子减小导致的,这意味着进一步提高RuO2/MOx-TiO2(M=Mn、Co)催化剂活性组分分散性才能开发出活性更好的催化剂。
The catalytic oxidation of hydrogen chloride to chlorine is a hot area of research due to its advantages such as high efficiency, low energy consumption and environment-friendliness. In this study, RuO2/TiO2 catalysts were prepared by incipient wetness impregnation, and Ru loading on catalysts was optimized via catalytic activity and H2-TPR measurement.Then, supports of MOx-TiO2 (M = Ce, Mn, La, Zr, Co) modified by oxides of Ce, Mn, La, Zr, Co and RuO2/MOx-TiO2 catalysts were prepared. Finally, the influences of different modifiers on the catalysts for HCl oxidation performance were investigated. Results show that,the optimal amount of Ru is around 2% ~ 3% for TiO2 support; all MOx modifiers are highly dispersed on MOx-TiO2 supports, and crystallite size of TiO2 increases after modifying with oxides of La, Zr and Ce, and oxides of Zr, Mn and Co, are doped into TiO2 lattice. Adding oxides of Ce and Zr improves catalytic activity of RuO2/TiO2, while oxides of Mn, Co, La exert negative effect on its activity. In addition, the addition of Mn and Co oxides can reduce activation energy of reaction. Thus, the reduction of pre-exponential factor leads to a lower catalytic activity of catalysts modified by oxides of Mn and Co. This indicates that it is viable to develop better catalysts for HCl oxidation by improving dispersity of active phase on RuO2/MOx-TiO2(M=Mn,Co).
目前, 全国副产氯化氢产量超过3.8 Mt· a-1, 未来5年将达到5 Mt· a-1, 大量副产氯化氢已成为制约众多涉氯行业发展的共同难题[1]。将副产物氯化氢转化为氯气, 实现氯资源循环利用是解决氯化氢排放和回收利用最有效、最经济环保的方法。氯化氢催化氧化制氯气又称Deacon过程, 所用催化剂称为Deacon催化剂。与电解法和化学氧化法相比, 催化氧化法具有高效率、低能耗、环境友好等优点, 适合用于大规模的氯化氢制氯气过程, 一直是研究的热点[2, 3, 4]。
Henry Deacon 在1868年提出了Deacon 过程, 直到1999年日本Sumitomo公司开发的RuO2/r-TiO2 Deacon催化剂取得突破性进展, 成功推广应用了多套工业装置, Deacon过程才真正进入工业化时代[5, 6]。随后, 德国Bayer公司也成功开发出同类型的RuO2/SnO2催化剂并经过中试验证。钌催化剂低温活性好, RuO2/r-TiO2催化剂使反应温度降至约300 ℃, 理论平衡转化率提高到90%~95%, 并且 RuO2的自限性深度氯化性质表现出优异的稳定性。尽管钌基Deacon催化剂已经商业化, 但贵金属负载量较高, 使用寿命仅两年, 投资和运行成本较高。
Hammes M等[7]采用高通量技术筛选氯化氢氧化催化剂, 其中Ru掺杂的Ce、Co、Ni氧化物筛选结果表明, Ru5Co95Ox活性和稳定性最佳, 不同氧化物修饰的RuO2性能存在较大差异。Amrute A P课题组等[8, 9]对比了γ -Al2O3、SiO2修饰的RuO2/SnO2催化剂, 发现RuO2/SnO2-Al2O3催化剂表现出优异的稳定性, 原因在于γ -Al2O3修饰后载体高温稳定性明显提高, 而SiO2却没有稳定效果, 进一步表征显示, γ -Al2O3不仅掺杂进入SnO2晶格影响载体的电子结构, 同时γ -Al2O3的几何效应能够防止RuO2颗粒的迁移。Sumitomo公司[6, 10]研究了SiO2、Al2O3、ZrO2、Nb2O5等修饰对RuO2/r-TiO2催化剂性能的影响, 发现SiO2的效果最佳, EXAFS测试结果显示, RuO2/SiO2/r-TiO2催化剂在运行两年后, 经Si
本文首先制备RuO2/TiO2催化剂, 并通过催化活性评价和H2-TPR表征优化Ru的负载量, 然后制备Ce、Mn、La、Zr、Co氧化物表面修饰TiO2的MOx-TiO2(M=Ce、Mn、La、Zr、Co)载体及RuO2/MOx-TiO2催化剂, 考察不同修饰物对催化剂氯化氢氧化性能的影响。
载体采用金红石相TiO2, 经过500 ℃焙烧2 h后使用。Ce、Mn、La、Zr、Co氧化物表面修饰TiO2的MOx-TiO2(M=Ce、Mn、La、Zr、Co)载体采用等体积浸渍法制备。TiO2等体积浸渍一定浓度的Ce、Mn、La、Zr、Co硝酸盐前驱体, 经过静置、110 ℃干燥和600 ℃焙烧形成MOx质量分数为2%的MOx-TiO2载体。
RuO2/TiO2及RuO2/MOx-TiO2催化剂采用等体积浸渍法制备, 等体积浸渍不同浓度的RuCl3溶液, 经过静置、干燥和焙烧即可。
采用荷兰帕纳科X’ Pert Powder型多功能粉末X射线衍射仪, CuKα , 工作电压为40 kV, 工作电流40 mA, 步幅0.02° , 扫描范围10° ~80° , 扫描速率5° · min-1。
H2-TPR 在美国麦克仪器公司AutoChem 2920化学吸附仪上进行, 0.1 g 催化剂在He气氛200 ℃吹扫1 h后, 降至室温, 切换至5%H2-He气氛, 待基线平稳后, 以10 ℃· min-1升温速率升至400 ℃。
采用常压固定床微分反应器, 将催化剂与0.6 g石英砂混合均匀后装入内径为6 mm 的石英管反应器中, 以升温速率5 ℃· min-1程序升温至反应温度, 反应气为HCl-O2混合气, 其中HCl流量为2.4 L· h-1, O2流量为1.2 L· h-1。尾气分析采用质量分数10%的KI溶液吸收, Cl2采用碘量法滴定, HCl采用酸碱滴定, 计算HCl转化率。
2.1.1 催化剂性能评价条件
催化剂性能评价时需要排除外扩散和内扩散的影响, 此外氯化氢氧化属于放热反应, 还需要消除热效应。本文所有催化剂评价过程中, 石英砂用于消除热效应影响。在高空速和转化率低于50%条件下, 保证催化剂不受外扩散的影响。
催化剂内扩散影响通过试验确定, 将Ru质量分数为2%的RuO2/TiO2催化剂颗粒分别筛分为(20~40)目、(40~60)目、(60~80)目, 然后将0.1 g催化剂与0.6 g相同目数的石英砂混合, 在常压和300 ℃条件下评价催化剂催化活性, HCl转化率如表1所示。
| 表1 催化剂颗粒尺寸对HCl转化率的影响 Table 1 Effect of catalyst particle size on the conversion of HCl |
由表1可以看出, HCl转化率随着催化剂颗粒尺寸的改变而变化, (40~60)目催化剂上HCl转化率明显高于(20~40) 目催化剂, 表明(20~40)目催化剂受内扩散影响明显; (60~80)目催化剂上HCl转化率与(40~60)目催化剂差别, 表明催化剂颗粒尺寸小于(40~60)目时, 内扩散的影响基本消除, 因此, 选择催化剂颗粒尺寸为(40~60)目。
2.1.2 Ru负载量
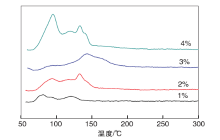
Ru的负载量不仅影响RuO2在TiO2表面的分散性, 也影响工业催化剂的成本。图1是Ru负载质量分数分别为1%、2%、3%、4%的RuO2/TiO2催化剂催化HCl氧化活性随着反应温度的变化。
 | 图1 Ru负载量对 RuO2/TiO2催化剂催化性能和时空收率的影响Figure 1 Influence of Ru loading on conversion and STY of RuO2/TiO2 |
由图1可以看出, 在同一反应温度下, HCl转化率随着Ru负载量升高而增大, Ru负载质量分数增大到3%和4%时, HCl转化率不再增加, 表明Ru最大负载量为3%。由图1还可以看出, 随着负载量增加, 单位质量Ru时空收率(STY-Ru)逐渐降低, 单位质量催化剂时空收率( STY-cat)增加至一定程度后保持不变。当Ru负载质量分数大于2%时, STY-Ru显著降低, 表明Ru的利用率较差, 而 STY-cat增加程度较小, 说明继续增加Ru负载量无法提高催化剂催化性能, 因此, 最佳Ru负载质量分数为2%~3%, 与文献[8]报道的金红石相SnO2载体理论负载量一致。
2.1.3 H2-TPR
不同Ru负载量的 RuO2/TiO2催化剂的H2-TPR谱图如图2所示。从图2可以看出, RuO2的还原峰主要在(60~80) ℃和(120~150) ℃。Debecker D P等[11]在nano-RuO2/TiO2 催化剂的H2-TPR表征过程中发现, 催化剂焙烧处理后第一个还原峰温度降低, 耗氢量增加, 经过XRD和XPS证明了焙烧导致RuO2颗粒烧结, 因此, 焙烧降低了RuOx物种与TiO2的相互作用力。本研究的催化剂经过300 ℃焙烧, 因此(60~80) ℃容易还原的峰为体相RuO2或是未与载体发生相互作用的RuOx物种, (120~150) ℃不容易还原的峰为RuO2与载体相互作用的RuOx物种。随着负载量增加, 与TiO2发生相互作用的RuOx物种比例增加, 负载质量分数为4%时, 容易还原的RuOx物种比例增加, 由此推断低负载量时, 有少量颗粒较大的RuO2形成, 大部分为与载体发生相互作用的RuOx物种, 负载量超过3%, 分散性显著降低, 大颗粒RuO2(或体相RuO2)大量出现, H2-TPR谱图也表明Ru负载质量分数小于3%有利于RuO2保持高分散性。
2.2.1 XRD
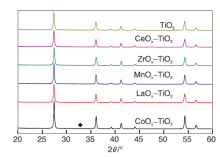
图3为TiO2和MOx-TiO2(M=Ce、Mn、La、Zr、Co)载体的XRD图。
由图3可以看出, 经过600 ℃焙烧, 除CoOx-TiO2载体在32.8° 出现较弱的CoTiO3 (104)晶面衍射峰外, Ce、Mn、La、Zr修饰的MOx-TiO2载体XRD图中只有金红石相TiO2(JCPDS 65-0191)的衍射峰, 表明MOx(M=Ce、Mn、La、Zr、Co)修饰物均呈高度分散状态。
图4是载体修饰前后(110)晶面衍射峰对比。
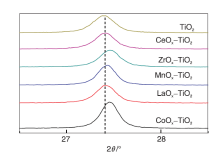 | 图4 载体修饰前后(110)晶面衍射峰对比Figure 4 Comparison of diffraction peaks from TiO2 (110) in support before and after modification |
由图4可以看出, (110)晶面衍射峰强度、半峰宽、衍射峰位置均发生变化。根据谢乐公式计算CoOx-TiO2、LaOx-TiO2、ZrOx-TiO2、CeOx-TiO2、MnOx-TiO2、TiO2的晶粒尺寸分别为33.6 nm、29.2 nm、28.6 nm、30.1 nm、34.4 nm、28.3 nm, 可见所有修饰型MOx-TiO2载体的晶粒尺寸均大于未修饰的TiO2, 其中La、Zr、Ce等熔点较高的金属氧化物修饰TiO2时, 晶粒尺寸略微增大, 而熔点较低的Co、Mn氧化物修饰组分的加入使载体更容易烧结。从衍射峰位置看, Zr、Mn、Co等修饰物的加入使衍射峰向高角度方向移动, 而加入La、Ce氧化物未改变2θ 位置。衍射峰向高角度方向移动表明晶胞发生收缩, 部分Zr、Mn、Co等氧化物掺杂进入TiO2晶格[12, 13, 14, 15]。
2.2.2 RuO2/MOx-TiO2催化剂氯化氢氧化性能
Ce、Mn、La、Zr、Co等氧化物修饰对RuO2/TiO2催化剂氯化氢氧化性能的影响如表2所示。
| 表2 不同催化剂上氯化氢氧化性能 Table 2 Performance of different catalysts for HCl oxidation |
由表2可以看出, 反应温度在300 ℃、320 ℃、350 ℃时, RuO2/CeOx-TiO2和RuO2/ZrOx-TiO2催化剂上HCl转化率均大于RuO2/TiO2, 而RuO2/MnOx-TiO2、RuO2/CoOx-TiO2、RuO2/LaOx-TiO2催化剂上HCl转化率均低于RuO2/TiO2催化剂, 表明Ce和Zr氧化物修饰可以提高催化剂活性, Mn、Co、La等氧化物修饰对活性有不利影响。然而, Hammes M等[7]在筛选不同氧化物掺杂催化剂的实验中发现, Ru5Ce95Ox的HCl氧化活性比Ru5Co95Ox低, CeOx和CoOx对活性影响顺序与本文结果相反, 表明修饰物的添加方式以及含量不同, 对催化剂活性的影响差异较大。此外, LaOx的修饰效果随反应温度发生改变, 在反应温度300 ℃时, RuO2/LaOx-TiO2催化剂上HCl转化率低于RuO2/MnOx-Ti
2.3.3 表观活化能对比
根据不同催化剂活性数据, 将反应速率lnr相对于1/T作图, 得到催化反应Arrhenius曲线, 如图5所示。
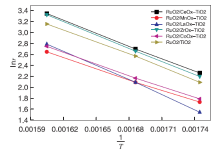 | 图5 不同催化剂上氯化氢氧化反应Arrhenius曲线Figure 5 Arrhenius plots of HCl oxidation reaction over different catalysts |
由Arrhenius曲线斜率计算获得反应的表观活化能, 不同催化剂上氯化氢氧化反应表观活化能为RuO2/MnOx-Ti
(1) 通过不同Ru负载量RuO2/TiO2催化剂催化活性评价、时空收率对比以及H2-TPR表征, 表明采用金红石相TiO2载体时最佳负载量为2%~3%。
(2) MOx-TiO2载体中MOx(M=Ce、Mn、La、Zr、Co)修饰物呈高分散状态; La、Zr、Ce等氧化物修饰后, TiO2晶粒尺寸略微增大, Mn、Co等氧化物修饰后TiO2晶粒尺寸显著增大; La、Ce氧化物主要是表面修饰, Zr、Mn、Co等氧化物掺杂进入了TiO2晶格。
(3) Ce和Zr氧化物修饰可以提高催化剂活性, Mn、Co、La等氧化物修饰对活性有不利影响; 修饰物的添加方式以及含量不同, 对催化剂催化活性的影响差异较大, 并且修饰效果可能随催化剂使用条件发生变化。
(4) Mn、Co氧化物修饰可以降低反应活化能, 但是指前因子的减小导致了催化剂催化活性较低; 只有制备活性组分为高分散性的RuO2/MOx-TiO2(M=Mn、Co)催化剂, 才能开发出活性更好的催化剂。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|