作者简介: 刘晓菊,1985年生,女,陕西省榆林市人,硕士,实验师,主要从事有机合成研究。
以L-缬氨酸和香兰素为起始原料,设计并合成了3种L-缬氨酸席夫碱金属配合物C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6,采用1H NMR、MS(EI)和元素分析等表征其结构。以3种L-缬氨酸席夫碱金属配合物作为光催化剂,研究25 ℃下,C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂在甲醇与水混合溶液中的亚甲基蓝降解性能。结果表明,3种催化剂对亚甲基蓝均有降解活性,其中,C13H20Sn2+NO6催化剂的亚甲基蓝降降解性能最好,预测这是一类潜在的环保性光催化材料。
Three novel photocatalytic materials(C13H20Fe2+NO6、C13H20Cu2+NO6and C13H20Sn2+NO6 ) were designed,synthesized with L-valine and vanillin as starting materials and characterized by1H NMR,MS(EI),elemental analysis and so on.At 25 ℃,the degradation property of MB over the catalysts was studied in the mixed solution of methanol and water.The results showed that all of the catalysts had certain degradation activity to MB,respectively.C13H20Sn2+NO6had the best catalytic activity especially.We forecast they are a kind of environmental friendly photocatalytic materials.
氨基酸及其衍生物主要应用于生物活性试剂和分析化学试剂[1, 2, 3, 4, 5]。含多功能基氨基酸希夫碱配体及其金属配合物在结构学、磁学、动力学和反应机理、配位反应、分析化学、催化、稳定剂染料和颜料以及农业等领域有着重要作用[6, 7, 8, 9]。
本文以L-缬氨酸和香兰素为原料, 合成新型具有手性L-缬氨酸希夫碱配体, 配体分别与金属盐FeSO4· 7H2O、CuSO4· 5H2O和SnCl2· 2H2O进行络合反应, 得到3种新型L-缬氨酸金属配合物C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6, 采用红外光谱仪、荧光分光光度计、质谱、紫外可见分光光度计和元素分析仪等对其进行表征, 并用紫外漫反射光谱测试其光催化性质。以3种L-缬氨酸席夫碱金属配合物作为光催化剂, 在可见光照射下, 考察C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂对亚甲基蓝降解活性的影响。
TU-1201紫外可见分光光度计, 北京普析通用仪器有限责任公司; RF-5301PC荧光分光光度计, 日本岛津公司; AXIMA-CFR plus MALDI-TOP Mass Spectrometer飞行质谱仪, 岛津集团英国克雷斯托分析仪器公司; 德国艾乐曼VarioEL Ⅲ 元素分析仪; EQUINOX-55傅里叶红外光谱仪, 德国布鲁克公司, 干燥KBr压片; VARIANINOVA-400核磁共振仪, 美国Varian公司, 溶剂DMSO。
试剂为市售分析纯试剂, 溶剂为市售工业级试剂, 对所有溶剂进行无水处理; 用自制的薄层色谱板。
在三颈烧瓶中加入L-缬氨酸0.117 g(1 mmol)、氢氧化钾(KOH) 0.056 g(1 mmol)和15 mL甲醇, 加热搅拌, 等待溶液变无色透明时, 缓慢滴加0.152 g(1 mmol)香兰素甲醇溶液(10 mL), 滴毕, 回流反应约2 h(TCL跟踪)。减压蒸除溶剂, 粗品用乙醇和蒸馏水重结晶得橘色固体0.19 g。产率:75%, IR(KBr, cm-1):3 417(stretch OH), 2 962(stretch CH3), 1 639(stretch C=N), 1 589(stretch Ph), 1 515(stretch Ph)。1H NMR(400 MHz, DMSO, 10-6)δ :0.77(6H, d, 2CH3), 0.83(1H, d, CH), 3.22(1H, s, OH), 3.42(1H, d, CH), 3.69(3H, s, CH3), 6.94~7.05(3H, m, Ar-H), 7.95(1H, s, N=CH), 9.42(1H, s, COOH)。LC-MS(M+1):calcd for C13H17NO4:251.12, found 251.28, Anal. calcd(%) for C13H17NO4:C, 62.14; H, 6.82; N, 5.57; found:C, 62.15; H, 6.87; N, 5.54。
在50 mL烧瓶中加入L-缬氨酸希夫碱配体0.251 g(1 mmol)和15 mL甲醇, 加热搅拌使其全部溶解, 分别加入1 mmol金属盐FeSO4· 7H2O、CuSO4· 5H2O和SnCl2· 2H2O, 回流反应2.5 h, 过滤, 用乙醇和蒸馏水重结晶分别得土褐色固体、深蓝色固体和黄色固体。
L-缬氨酸希夫碱铁金属配合物C13H20Fe2+NO6:土褐色固体0.18 g, 产率:50%, IR(KBr), ν (cm-1):3 474, 3 430, 3 153, 3 062, 2 974, 2 949, 2 740, 2 619, 1 670, 1 586, 1 510, 1 453, 1 422, 1 384, 1 320, 1 289, 1 270, 1 200, 1 168, 1 149, 1 105, 1 061, 846, 807, 757, 718, 712, 630, 579, 535, 421; LC-MS(M+1):343, Anal. calcd(%) for C13H20Fe2+NO6:C, 45.64; H, 5.89; N, 4.09; found C, 45.60; H, 5.90; N, 4.05。
L-缬氨酸希夫碱铜金属配合物C13H20Cu2+NO6:深蓝色固体0.16 g, 产率:45%; IR(KBr), ν (cm-1):3 227, 3 151, 2 961, 2 866, 2 734, 1 669, 1 625, 1 580, 1 504, 1 453, 1 422, 1 377, 1 289, 1 263, 1 200, 1 162, 1 143, 1 124, 1 022, 852, 807, 731, 630, 579, 541, 427; LC-MS(M+1):350, Anal.calcd(%) for
L-缬氨酸希夫碱锡金属配合物C13H20Sn2+NO6:黄色固体0.22 g, 产率:55%; IR(KBr), ν (cm-1):3 430, 3 088, 3 019, 1 668, 1 592, 1 504, 1 466, 1 428, 1 390, 1 301, 1 263, 1 200, 1 168, 1 149, 1 124, 1 022, 934, 858, 807, 770, 731, 624, 585, 548, 478; LC-MS(M+1):406.03, Anal.calcd(%) for C13H20Sn2+NO6:C, 38.55; H, 4.98; N, 3.46; found C, 38.53; H, 4.97; N, 3.49。
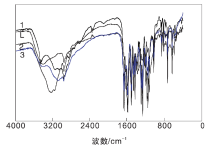
图1为L-缬氨酸希夫碱及其金属配合物的红外谱图。由图1可见, L-缬氨酸希夫碱在1 639 cm-1处有强烈的伸缩振动峰, 为— C=N— 键, 表明希夫碱配体生成。C13H20Fe2+NO6催化剂在1 670 cm-1处是— C=N— 键的伸缩振动峰, 相比配体中的峰值红移31 cm-1, N— Fe和O— Fe配位键吸收峰分别在535 cm-1和421 cm-1; C13H20Cu2+NO6催化剂在1 669 cm-1处是— C=N— 键的伸缩振动峰, 相比配体中的峰值红移30 cm-1, N— Cu和O— Cu配位键吸收峰分别在541 cm-1和427 cm-1; C13H20Sn2+NO6催化剂在1 668 cm-1处是— C=N— 键的伸缩振动峰, 相比配体中的峰值红移约28 cm-1, N— Sn和O— Sn配位键吸收峰分别在585 cm-1和478 cm-1, 红外数据表明目标产物生成。
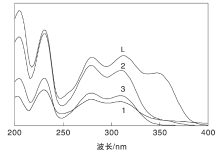
图2为L-缬氨酸希夫碱及其金属配合物的荧光光谱图, L-缬氨酸希夫碱及其金属配合物溶解在甲醇和水的混合溶剂中[V(CH3OH):V(H2O)=1:1], 浓度均为5× 10-6 mol· L-1, 激发波长λ ex=410 nm。
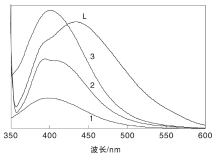 | 图2 L-缬氨酸希夫碱及其金属配合物的荧光光谱图L为配体; 1为C13H20Fe2+NO6催化剂; 2为C13H20Cu2+NO6催化剂; 3为C13H20Sn2+NO6催化剂Figure 2 Fluorescence emission spectra of title complexes |
由图2可知, C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂相对配体分别蓝移了约15.7 nm、22 nm和12.6 nm, 表明配体与金属配位后结构的共轭性和刚性变弱。
图3为L-缬氨酸希夫碱及其金属配合物的紫外光谱图。L-缬氨酸希夫碱及其金属配合物溶解在甲醇和水的混合溶剂中[V(CH3OH):V(H2O)=1:1], 浓度均为5× 10-6 mol· L-1。从图3可以看出, 配体与金属络合后347.8 nm处的吸收峰消失, 其他对应的吸收峰强度变弱。进一步表明配体与金属发生了配位, 由于3种金属配合物结构的不同, 导致其紫外吸收谱图有差异。
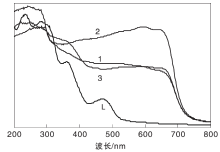
图4为L-缬氨酸希夫碱及其金属配合物的紫外漫反射吸收光谱图。由图4可知, 配体在(260~540)nm即主要在紫外区有强的漫反射吸收, 但是生成的金属络合物很明显在可见光区有漫反射吸收。由此推测, 配体在紫外区可以作为光催化剂材料, C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂可以作为可见区光催化材料。
催化剂用量为0.2 g· L-1, 加入盛有10 mL浓度为1× 10-4mol· L-1亚甲基蓝溶液的石英管中, 置入光催化反应仪暗室中搅拌1.0 h, 确保催化剂与亚甲基蓝达到吸附-脱附平衡。在功率500 W氙灯光照下进行光催化降解反应, 每隔30 min取出1支管进行离心处理, 并用滤膜过滤处理。采用紫外分光光度计测定各个反应阶段的亚甲基蓝浓度。研究C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂在可见光照射条件下催化降解亚甲基蓝性能, 结果见图4。
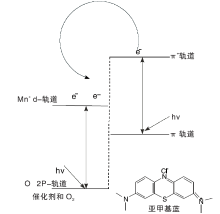
由图5可见, 可见光照射下, 亚甲基蓝几乎不发生光解。光照240 min, C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂上亚甲基蓝降解率分别为25.1%、17.0%和55.1%, 表明C13H20Sn2+NO6催化剂的催化活性最高。推测目标产物的光降解机理(图6), 可能是金属配合物的价带电子在可见光照射下被激发到导带上从而产生光电流, 在价带上留下了电子空穴。电子和空穴之间可以产生自由基, 从而使电子和空穴在化合物中达到有效分离, 促使亚甲基蓝降解。
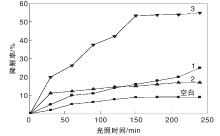 | 图5 催化剂对亚甲基蓝降解率的影响1为C13H20Fe2+NO6催化剂; 2为C13H20Cu2+NO6催化剂; 3为C13H20Sn2+NO6催化剂Figure 5 MB degradation curves under visible light irradiation (λ > 400 nm) over various photocatalysts |
(1) 以L-缬氨酸和香兰素为原料, 合成新型具有手性氨基酸希夫碱配体, 配体分别与FeSO4· 7H2O、CuSO4· 5H2O和SnCl2· 2H2O进行络合反应, 得到3种新型L-缬氨酸席夫碱金属配合物C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO, 合成条件简易, 在空气中稳定。
(2) 以3种金属配位化合物为催化剂, 配制模型污染物亚甲基蓝浓度为1× 10-4mol· L-1, 在催化剂用量0.2 g· L-1、反应温度25 ℃和光照时间240 min条件下, 考察3种催化剂的亚甲基蓝降解性能。结果表明, 在可见光照射下, C13H20Fe2+NO6、C13H20Cu2+NO6和C13H20Sn2+NO6催化剂对亚甲基蓝降解率分别为25.1%、17.0%和55.1%, 其中, C13H20Sn2+NO6催化剂的亚甲基蓝降降解性能最好, 预测将是一类环保新型污水处理剂, 有待进一步优化其性能。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|