作者简介:王 杰, 1991年生, 男,山西省临汾市人,在读硕士研究生。
分别采用浸渍法、沉积-沉淀法和共沉淀法制备了Ni-Al2O3催化剂,采用H2-TPR/TPD、XRD、NH3-TPD等对催化剂进行表征,并研究其催化乙酰丙酸加氢性能。结果表明,共沉淀法制备的催化剂中存在强的金属-载体相互作用、活性金属分散度高以及丰富的酸性中心。该催化剂表现出优异的催化乙酰丙酸加氢合成g-戊内酯性能以及高的使用稳定性。在160 ℃和4 MPa氢气压力反应条件下,乙酰丙酸转化率与g-戊内酯选择性可分别达85.0%和78.0%,催化剂循环使用3次时活性仍基本保持恒定。
Ni-Al2O3 catalysts were prepared by impregnation,deposition-precipitation,co-precipitation respectively,characterized by H2-TPR/TPD,XRD and NH3-TPD techniques and evaluated in liquid-phase hydrogenation of levulinic acid with ethanol as solvent.The results demonstrated that strong metal-support interaction,highly dispersion of Ni species and large amounts of acidic sites were detected in catalyst prepared by co-impregnation method.The catalyst prepared by co-impregnation exhibited superior performance and highly stability in the synthesis of g-valerolactone via levulinic acid hydrogenation.85.0% conversion of levulinic acid with 78.0% selectivity of g-valerolactone had been achieved at 160 ℃, 4 MPa of H2 pressure using ethanol as solvent.Both conversion of levulinic acid and selectivity of g-valerolactone remained almost constant after reuse of 3 times.
乙酰丙酸可由广泛存在的木质纤维素经酸催化水解制得, 其分子内含有羰基与羧基官能团。乙酰丙酸经加氢可合成g-戊内酯、1, 4-戊二醇、2-甲基呋喃、戊酸酯等一系列高附加值化学品[1]。其中, g-戊内酯广泛应用于食品添加剂、燃料添加剂、溶剂、汽油、柴油以及多种化工中间体的合成等领域, 被认为是用于生产可再生燃料和化工产品最具潜力的生物平台分子之一[2]。
应用于乙酰丙酸加氢的催化剂包括Ru、Rh、Pt、Pd、Au等贵金属催化剂, 也包括Ni、Cu、Co非贵金属催化剂。贵金属催化剂较非贵金属催化剂具有高的加氢活性与加氢选择性, 但由于其高昂的价格和储量有限性, 限制了其在大规模工业化中的应用。关于非贵金属催化剂催化乙酰丙酸加氢性能的研究逐步引起研究者的重视。Christian Robert V等[3]使用雷尼Ni催化剂催化乙酰丙酸加氢, 在反应温度为220 ℃时, g-戊内酯收率可达94%。Mohan V等研究了载体[4]以及Ni含量[5]对Ni基催化剂乙酰丙酸加氢性能的影响, 当以H-ZSM-5为载体, Ni质量分数为30%时, g-戊内酯的生成速率最大为0.9090 kg· (kg-催化剂· h)-1, 性能优于炭负载的Ru、Pd、Pt催化剂[6], 也优于Cu/SiO2催化剂[7], 但该催化剂运行3 h时即开始失活。Sun Daolai等[8]研究了Al2O3与SiO2负载的Ni、Cu、Co催化剂催化乙酰丙酸和乙酰丙酸甲酯气相加氢性能, Cu/Al2O3催化剂具有较高的乙酰丙酸甲酯加氢活性和g-戊内酯选择性, Ni/SiO2催化剂则具有最高的乙酰丙酸加氢活性和g-戊内酯选择性。但上述催化剂活性在反应起始时即开始缓慢降低。因此, 如何制备高活性及高使用稳定性的乙酰丙酸加氢催化剂是工业化催化剂研发的重要课题。
以Al2O3为载体的Ni基催化剂在许多催化反应, 如加氢[9, 10, 11]、重整[12]、氧化[13, 14]等反应中表现出优异的催化性能。催化剂的制备方法对催化剂织构性质、表面性质以及反应性能有重要影响。本文分别采用浸渍法、沉积-沉淀法和共沉淀法制备Ni-Al2O3催化剂, 研究其表面性质及催化乙酰丙酸加氢性能, 以期为高性能乙酰丙酸加氢制g-戊内酯催化剂的研发提供指导。
分别采用浸渍法、沉积-沉淀法和共沉淀法制备催化剂, 催化剂中Ni与Al物质的量比为2∶ 1。浸渍法是以Ni(NO3)2· 6H2O为前驱物, 等体积浸渍于一定量的γ -Al2O3, 静置3 h后于100 ℃烘箱中干燥12 h, 然后马弗炉中500 ℃焙烧6 h, 标记为Ni2Al-IM; 沉积-沉淀法是将适量的γ -Al2O3粉末分散于一定浓度的Ni(NO3)2· 6H2O溶液中, 搅拌下滴加NaOH溶液, 保持pH=6~7, 老化3 h, 离心洗涤至中性, 100 ℃烘12 h, 马弗炉中500 ℃焙烧6 h, 标记为Ni2Al-DP; 共沉淀法是将Ni(NO3)2· 6H2O和Al(NO3)3· 9H2O按一定比例配制成混合溶液, 以Na(OH)溶液为沉淀剂, 用恒压滴液漏斗分别将上述两溶液逐滴滴加到三口烧瓶中, 于65 ℃恒温水浴中不断搅拌并控制pH=6~7, 滴加完毕后继续搅拌30 min, 将混合浆液转移至水热釜中, 120 ℃烘箱中老化6 h后取出, 冷却后用去离子水洗涤至中性、干燥, 500 ℃下焙烧6 h, 标记为Ni2Al-CP。各催化剂均在H2气氛550 ℃还原。
N2物理吸附-脱附表征在美国麦克仪器公司ASAP 2020型自动物理吸附仪上进行; XRD在Bruker D8 Advance型X射线衍射仪上进行, CuKα , 工作电压40 kV, 工作电流40 mA, 扫描范围10° ~80° , 扫描速率为6 ° · min-1; 在美国麦克仪器公司ASAP 2920型化学吸附仪上进行氢气程序升温还原, 氢气程序升温脱附以及氨程序升温脱附表征, 用热导池检测器检测耗氢量、脱氢量以及氨脱附量; 采用Thermo-Fisher iCAP 7400型ICP-OES进行催化剂中各元素含量分析。
催化剂活性评价在不锈钢高压釜中进行, 将一定量、一定粒径[(0.28~0.45) mm]的催化剂、1.67 g乙酰丙酸和40 mL乙醇加入反应釜中, 充氢气至所需压力, 待高压釜加热至反应温度时, 开启搅拌器开始计时反应, 搅拌转速为400 r· min-1。反应产物用气相色谱进行分析。
表1为制备的各催化剂织构参数。从表1可以看出, 以共沉淀法制备的Ni2Al-CP催化剂比表面积最大, 为117 m2· g-1, 浸渍法制备Ni2Al-IM催化剂比表面积最小, 为64 m2· g-1。催化剂的平均孔径以及孔容变化规律不同于比表面积。ICP结果表明, Ni2Al-IM、Ni2Al-DP和Ni2Al-CP催化剂中n(Ni)∶ n(Al)分别为2.25、2.21和2.17, 催化剂中Ni含量基本一致。
| 表1 各催化剂的织构参数 Table 1 Textural property of catalysts |
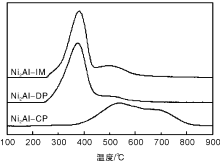
对于Ni基催化剂, 在NiO还原为金属Ni的过程中没有中间态, 所以TPR谱中不同温度段的耗氢峰可归属为与载体存在不同相互作用的NiO的还原。大量研究表明[15, 16], 金属-载体间相互作用的不同引起金属还原行为有所差异:体相NiO由于与载体间没有相互作用, 耗氢峰为(350~400) ℃; 当NiO高度分散在Al2O3载体表面, 较强的金属-载体相互作用使NiO的还原峰出现在500 ℃以上。图1为各催化剂的H2-TPR谱图。
由图1可以看出, Ni2Al-IM、Ni2Al-DP催化剂的耗氢峰由约380 ℃出现的主耗氢峰以及500 ℃处的肩峰组成, 主耗氢峰可归属为与体相NiO类似的Ni物种的还原, 肩峰归属为与载体有强相互作用的Ni物种的还原。主耗氢峰峰面积远大于肩峰峰面积, 表明在Ni2Al-IM、Ni2Al-DP催化剂中Ni物种主要以与体相NiO类似的形式存在。
与Ni2Al-IM、Ni2Al-DP催化剂的还原行为不同, Ni2Al-CP催化剂在(400~800) ℃出现两个连续的界限不明的耗氢峰, 相应的峰顶温度分别为540 ℃与690 ℃, 低温耗氢峰归属为与载体有强相互作用的NiO的还原, 高温耗氢峰则归属为表面NiAl2O4类似的Ni物种的还原。表明Ni2Al-CP催化剂中金属-载体相互作用显著强于Ni2Al-IM与Ni2Al-DP催化剂。
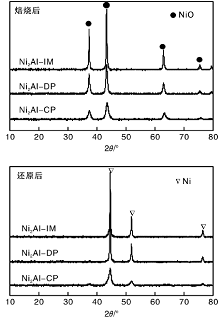
图2为各催化剂焙烧后和还原后的XRD图。
从图2可以看出, 焙烧后各催化剂均在37.2 ° 、43.2 ° 以及62.9° 呈现出NiO物种的特征衍射峰, 表明焙烧过程中制备催化剂前驱物已转化为氧化物。与Ni2Al-IM和Ni2Al-DP相比, Ni2Al-CP催化剂的NiO衍射峰明显宽化, 峰强度也显著减弱, 表明Ni2Al-CP催化剂中NiO分散度较高。结合NiO(200)晶面衍射峰数据, 通过谢乐公式计算得到Ni2Al-IM、Ni2Al-DP以及Ni2Al-CP催化剂中NiO晶粒尺寸分别为29.0 nm、14.9 nm和9.8 nm。从图2还可以看出, 还原后各催化剂的NiO物种特征衍射峰消失, 分别在44.5° 、51.8° 和76.4° 呈现出金属Ni的特征衍射峰, 表明在还原过程中NiO物种还原为金属Ni。利用谢乐公式和Ni(111)晶面的衍射峰数据, 计算得到Ni2Al-IM、Ni2Al-DP以及Ni2Al-CP催化剂中金属Ni晶粒尺寸分别为34.3 nm、29.0 nm和9.3 nm。在还原过程中, 浸渍法和沉积-沉淀法制备催化剂中的Ni物种逐渐迁移聚集, 晶粒尺寸有所增大。Ni2Al-CP催化剂中Ni物种晶粒尺寸基本恒定, 这可能是因为NiO与Al2O3之间较强的相互作用, 抑制了Ni物种在还原过程中的迁移, 使Ni物种以较高分散态存在催化剂中。
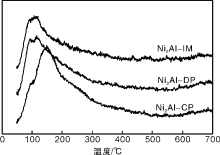
图3为各催化剂的H2-TPD谱图。
由图3可见, 在(50~500) ℃内, 各催化剂呈现一宽化的氢气脱附峰, 可归属为金属Ni表面氢气的脱附。根据脱附峰面积, 计算Ni2Al-IM、Ni2Al-DP以及Ni2Al-CP催化剂表面的氢气脱附量分别为91 μ mol· g-1、114 μ mol· g-1和168 μ mol· g-1(见表1)。Ni2Al-CP催化剂的氢气脱附量最大, 显著优于Ni2Al-IM与Ni2Al-DP催化剂。这主要是由于Ni2Al-CP催化剂中活性金属Ni晶粒尺寸小, 分散度高, 暴露于表面的Ni原子数目最多, 因而具有较多的氢气吸附活化位点[17, 18]。
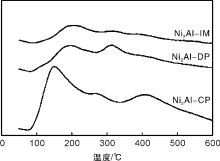
图4为各催化剂的NH3-TPD谱图。由图4可见, Ni2Al-IM与Ni2Al-DP催化剂在(100~400) ℃内呈现一极为宽化的NH3脱附峰, 表明表面存在少量的弱酸和中强酸酸性中心[19, 20]。Ni2Al-IM与Ni2Al-DP催化剂表面酸量分别为0.39 mmol· g-1与0.61 mmol· g-1。而Ni2Al-CP催化剂则在(100~600) ℃内呈现界限不明显的3个连续NH3脱附峰。其表面存在丰富的弱酸、中强酸和强酸酸性中心, 其总酸量达1.23 mmol· g-1。
据文献[21, 22]报道, 以醇为溶剂时, 乙酰丙酸易先与醇发生酯化反应生成乙酰丙酸酯, 然后经C=O加氢生成4-羟基戊酸酯, 进一步环化脱醇生成γ -戊内酯。在乙酰丙酸用量1.67 g、催化剂用量0.1 g、40 mL乙醇为溶剂、反应温度160 ℃、反应时间3 h、氢气压力4 MPa和搅拌速率400 r· min-1的条件下, 不同催化剂催化乙酰丙酸加氢评价结果见表2。
| 表2 各催化剂催化乙酰丙酸加氢评价结果 Table 2 Catalytic performance of catalysts for hydrogenation of levulinic acid |
由表2可知, Ni2Al-IM、Ni2Al-DP和Ni2Al-CP催化剂上乙酰丙酸转化率分别为56.0%、76.3%和85.0%。乙酰丙酸转化率与催化剂表面酸量呈正比关系, 这主要是由于具有较多酸性中心的催化剂有利于乙酰丙酸与乙醇反应生成乙酰丙酸乙酯。Ni2Al-IM、Ni2Al-DP和Ni2Al-CP催化剂上目标产物g-戊内酯选择性分别为75.0%、76.0%和78.0%, g-戊内酯选择性基本一致。由于Ni2Al-IM、Ni2Al-DP以及Ni2Al-CP催化剂的乙酰丙酸转化率依次增大, 也代表了其催化C=O加氢活性依次增高。
结合XRD、H2-TPR和H2-TPD表征结果可知, Ni2Al-CP催化剂中存在强的金属-载体相互作用, 活性金属Ni物种分散度较高, 催化剂表面存在较多的氢气吸附活化位点, 这可能是其具有较高C=O加氢活性的原因之一。本课题组关于顺酐加氢的研究表明, 催化剂表面酸性中心可与活性金属协同作用促进C=O加氢[23], Luo Wenhao等[24]关于Ru基催化剂催化乙酰丙酸加氢性能的研究也表明, 催化剂表面酸性位点的存在可提高催化剂的C=O加氢活性。因此, 我们推测, Ni2Al-CP催化剂表面丰富酸性中心的存在是其具有高C=O加氢活性的另一原因。
在乙酰丙酸用量1.67 g、催化剂用量0.1 g、40 mL乙醇为溶剂、反应温度160 ℃、反应时间3 h、氢气压力4 MPa和搅拌速率400 r· min-1的条件下, 各催化剂重复使用性能见表3。
| 表3 各催化剂重复使用性能 Table 3 Effect of run times on catalytic performance of catalysts for levulinic acid hydrogenation |
从表3可以看出, 在相同反应条件下, 各催化剂循环使用次数由1次增加至3次时, Ni2Al-IM催化剂上乙酰丙酸转化率由56.0%降至35.3%, g-戊内酯选择性由75.0%降至43.6%; Ni2Al-DP催化剂上乙酰丙酸转化率由76.3%降至35.9%, g-戊内酯选择性由76.0%降至49.3%; 与Ni2Al-IM和Ni2Al-DP催化剂不同, Ni2Al-CP催化剂上乙酰丙酸转化率由85.0%降至84.1%, g-戊内酯选择性由78.0%降至76.8%, 乙酰丙酸转化率与g-戊内酯选择性基本恒定。Ni2Al-CP催化剂表现出高的循环使用稳定性, 这可能是因为Ni2Al-CP催化剂中存在强的金属-载体相互作用, 阻止了在反应过程中活性金属Ni物种的流失[25]。
与浸渍法和沉积-沉淀法制备的催化剂相比, 共沉淀法制备的Ni-Al2O3催化剂具有强的金属-载体相互作用, 高的活性金属分散度和丰富的表面酸性中心。丰富的酸性中心以及高的金属分散度使该催化剂表现出优异的催化乙酰丙酸加氢合成g-戊内酯性能, 强的金属-载体相互作用阻止了在反应过程中活性金属Ni物种的流失, 进而表现出高的使用稳定性。以共沉淀法制备的Ni-Al2O3催化剂具有较好的乙酰丙酸加氢工业应用潜质。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|