作者简介:黄梅, 1993年生,女,山东省淄博市人,硕士, 研究方向为废聚合物再资源化。
以离子液体1-丁基-3-甲基咪唑溴盐([Bmim]Br)为催化剂,对废旧尼龙6水解反应进行研究。采用FT-IR、TG、GC-MS和UV等对产物进行定性和定量分析。考察反应温度、反应时间、催化剂用量和水用量对尼龙6转化率和产物收率的影响。结果表明,固相产物为未解聚完全的尼龙6,液相产物主要为己内酰胺。硅胶柱层析分离纯化己内酰胺,并利用FT-IR和1H NMR对产物结构进行表征。获得较佳水解条件为: m(尼龙6): m(催化剂): m(H2O)=1:6:3,反应温度175 ℃,反应时间9 h,此条件下,尼龙6转化率46.00%,己内酰胺收率为24.56%。
Hydrolysis of waste nylon 6 was investigated by using ionic liquid 1-butyl-3-methylimidazolium bromide([Bmim]Br) as catalyst.The obtained products were qualitatively and quantitatively analyzed by FT-IR,TG,GC-MS and UV-Vis.Effects of reaction temperature,reaction time,amount of catalyst and water on hydrolysis of nylon 6 were investigated.The results showed that solid phase product was undepolymerized nylon 6,liquid phase product was mainly caprolactam and some oligomers.Caprolactam was separated and purified by silica gel column chromatography,characterized by FT-IR and1H NMR.Optimum reaction conditions were that mass ratio of nylon 6 to [Bmim]Br was 1:6,mass ratio of nylon 6 to water was 1:3,reaction temperature was 175 ℃ and reaction time was 9 h.Under these conditions,conversion of nylon 6 was 46.00% and yields of caprolactam was 24.56%.
尼龙6是一种综合性能良好的热塑性材料, 具有耐磨性好、电性能佳、抗冲击性强和耐腐蚀等特点, 广泛应用于电子、汽车、包装、建材和机械等领域, 其产量与消费居五大工程塑料之首[1]。然而, 消费量的快速增长带来废弃物剧增的问题, 对环境造成严重危害。随着环境问题的日益突出和公众环保意识的增强, 废料处理及其循环利用成为普遍关注和亟需解决的问题[2]。通过化学方法使聚合物材料解聚回收相应单体, 是同时具有环境效益和社会经济效益最有效途径之一[3]。
目前, 尼龙6的化学回收方法主要有热解法[4]、氨解法[5]、水解法[6, 7, 8](高温高压水解法、酸水解法、碱水解法)和超临界法[9, 10](超临界水法、超临界醇法)等, 但大多数都需要在高温、高压或强酸、强碱条件下进行, 对反应设备要求很高, 工艺操作存在一定危险性。离子液体作为一种新型绿色介质, 在废旧高聚物降解方面表现出优异特性:结构可调性, 不挥发性, 高热稳定性, 易分离性, 受到日益关注与研究。
本文以离子液体[Bmim]Br为催化剂, 对尼龙6的水解反应进行研究, 得到相应单体己内酰胺。利用FT-IR、TG、GC-MS和UV对产物进行定性和定量分析。探讨反应温度、反应时间、催化剂用量和水用量对水解反应的影响, 优化工艺条件。
尼龙6, 德国巴斯夫有限公司; N-甲基咪唑, 工业级, 广州市金圣吉化工有限公司; 1-溴正丁烷, 分析纯, 上海山浦化工有限公司; 乙酸乙酯、二氯甲烷, 分析纯, 天津市大茂化学试剂厂; 乙醇, 分析纯, 天津市巴斯夫化工有限公司; 己内酰胺, 分析纯, 成都市科龙化工试剂厂; 硅胶, (200~300)目, 精制型, 青岛海洋化工厂分厂。
GCMS-QP2010气质联用仪、UV2600紫外分光光度计, 日本岛津公司; 510P红外光谱仪, 美国尼高力公司; AV500核磁共振波谱仪, 德国布鲁克公司; STA449C同步热分析仪, 德国耐驰公司。
将精制的8.21 g (0. 1mol) N-甲基咪唑置于100 mL三口烧瓶中, 冰水浴下滴加16.44 g (0.12 mol) 1-溴正丁烷, 滴加完毕室温搅拌反应1.0 h, N2氛围下, 70 ℃加热搅拌回流反应24 h, 趁热将反应液倒入乙酸乙酯中搅拌以除去未反应1-溴正丁烷, 过滤收集析出白色晶体, 80 ℃真空干燥2 h, 得到纯度较高的白色固体1-丁基-3-甲基咪唑溴酸盐。
称取一定量尼龙6、离子液体和蒸馏水置于密闭带有磁力搅拌和温度计的高压釜中, 在设定温度下加热搅拌反应一定时间。反应结束后, 将高压釜放入水中冷却至室温, 过滤分离反应产物, 滤饼经烘干称重, 得未反应尼龙6, 滤液用10 mL二氯甲烷萃取3次, 分离产物与离子液体。将萃取得到的液相产物置于100 mL容量瓶中, 用二氯甲烷定容至刻度线, 移取1.0 mL于10 mL容量瓶中配制成待测溶液。
利用FT-IR和TG对固相产物进行定性分析。
利用红外光谱仪对尼龙6原料和水解后固体残渣进行对比分析, 溴化钾压片。
利用热重分析仪分别对尼龙6原料和反应后固相残渣进行研究。N2为实验载气, 20 mL· min-1, 从室温以10 ℃· min-1的速率升温至800 ℃。
采用GC-MS对液相产物进行定性分析。色谱柱Rxi-5Sil MS(30 m× 0.25 μ m× 0.25 mm); 氦气为载气, 柱流量1.61 mL· min-1, 进样量0.5 μ L, 分流进样, 分流比140: 1, 溶剂延迟3.5 min, 进样温度240 ℃, 柱温:程序升温, 初始温度60 ℃, 保持2 min, 10 ℃· min-1速率升温至200 ℃, 保持2 min。质谱条件:电子轰击(EI)离子源, 轰击电压70 eV, 离子源温度250 ℃; 质量扫描范围(40~400)amu。
根据己内酰胺(220~240) nm有紫外吸收特点, 利用紫外分光光度计对其进行定量分析, 计算收率。
称取己内酰胺样品5 g置于100 mL容量瓶中, 用二氯甲烷定容, 配制成50 g· L-1的己内酰胺母液。分别移取母液0.4 mL、0.8 mL、1.2 mL、1.6 mL和 2.0 mL置于100 mL容量瓶中, 定容后即得到浓度分别为0.2 g· L-1、0.4 g· L-1、0.6 g· L-1、0.8 g· L-1和1.0 g· L-1的己内酰胺标准溶液。
以二氯甲烷为空白溶剂, 测定己内酰胺标准溶液在(200~600) nm的吸光度, 根据紫外吸收谱图确定己内酰胺最大吸收波长。
以二氯甲烷为空白溶剂, 在确定最大吸收波长下测定己内酰胺标准曲线系列浓度的吸光度值, 以标准溶液浓度对吸光度进行线性回归, 建立己内酰胺含量测定的标准曲线方程。
以V(乙酸乙酯): V(乙醇)=3: 1为流动相, 硅胶为固定相, 采用柱层析法分离纯化产物, 旋蒸后得到白色晶体。
2.1.1 FT-IR
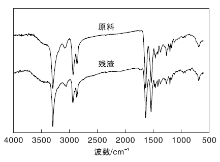
图1为尼龙6原料和反应后固体残渣的FT-IR谱图。
从图1可以看出, 反应后固体残渣和尼龙6原料出峰位置基本相同。在约3 300 cm-1和1 640 cm-1处分别为酰胺基团中的N— H和C=O的伸缩振动吸收峰; 在约1 543 cm-1处为N— H的弯曲振动吸收峰; 在约1 264 cm-1处为C— N— H的振动吸收峰; 在约688 cm-1处出现吸收峰是由N— H的面外摇摆振动引起的; 在约2 942 cm-1和2 868 cm-1处为亚甲基— CH2的伸缩振动吸收峰, 表明固体残渣为未反应完全的尼龙6。
2.1.2 TG
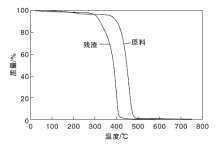
尼龙6原料和反应后固体残渣的热重分析结果如图2所示。
从图2可以看出, 尼龙6原料具有较好的热稳定性, 其初始分解温度约382 ℃。随着尼龙6不断水解, 尼龙6降解率逐渐增加, 其固体残渣稳定性呈下降趋势, 水解固体残渣的初始分解温度降低, 约为290 ℃, 表明尼龙6的大分子链随着降解率的增大而不断断裂成小分子链, 导致尼龙6水解后固体残渣热稳定变差。
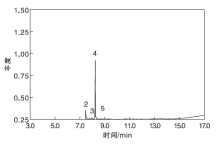
液相产物[m(尼龙6): m(催化剂): m(H2O)=1: 6: 3, 175 ℃, 9 h]的GC-MS分析如图3所示。通过对比标准谱图库数据, 发现尼龙6水解反应的液相产物主要为己内酰胺(峰号4)、N-甲基己内酰胺及其他副产物小分子。
2.3.1 FT-IR
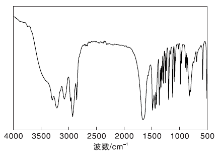
提纯后液相产物的FT-IR谱图如图4所示。
从图4可以看出, 在约1 657 cm-1处出现的强吸收峰为酰胺基团中C=O的伸缩振动吸收峰; 在约3 215 cm-1处出现的吸收峰为N— H的伸缩振动吸收峰; 在约1 440 cm-1处出现N— H的弯曲振动吸收峰; 在约1 365 cm-1处出现吸收峰是由C— N的伸缩振动和N— H的弯曲振动同时引起的合频峰; 在2 929 cm-1和2 856 cm-1处出现的吸收峰为亚甲基— CH2的伸缩振动吸收峰。与尼龙6原料的红外谱图相比, 产物的酰胺基团谱峰发生较大的变化, 这是由于酰胺成环变成内酰胺的缘故。通过分析, 初步确定提纯后产物为己内酰胺。
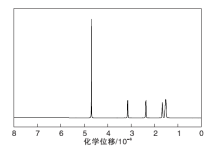
2.3.2 1H NMR
为进一步确定产物结构, 对提纯后液相产物进行1H NMR表征, 重水作为溶剂, 结果如图5所示。
己内酰胺核磁数据分析如下:在δ =4.69× 10-6是溶剂峰, N-H上的H质子与重水发生活泼H交换, H峰消失; 在δ ≈ 3.15× 10-6出现的多重峰归属为与— NH相连的亚甲基— CH2— 上的2个H质子; 在δ ≈ 2.37× 10-6出现的三重峰归属为与— C=O相连的亚甲基— CH2— 上的2个H质子; 在δ ≈ 1.66× 10-6出现的多重峰归属为距离酰胺基团距离最远的亚甲基— CH2— 上的2个H质子; 在δ ≈ 1.54× 10-6出现的多重峰归属为剩余两个亚甲基— CH2— 上的4个H质子。经IR和1H NMR确认产物结构即为己内酰胺。
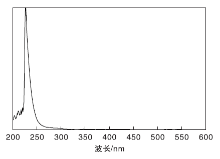
2.4.1 最大吸收波长的确定
紫外吸收扫描结果如图6所示。从图6可以看出, 己内酰胺溶液在226 nm有明显的吸收峰。因此, 确定己内酰胺含量测定的波长为226 nm。
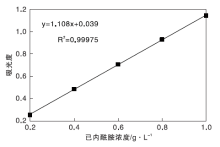
2.4.2 标准曲线方程的确立
为己内酰胺含量测定标准曲线, 以己内酰胺溶液浓度为横坐标, 吸光度值为纵坐标, 通过线性拟合得到标准曲线方程:y=1.108x+0.039。
由图7可知, 在波长下226 nm己内酰胺浓度与所测吸光度值有较好的线性关系(R2=0.999 75)。己内酰胺收率计算公式如下:
己内酰胺收率=
式中, y代表一定浓度下对应的吸光度值; w1代表尼龙质量; M1代表尼龙6重复单元的摩尔质量; M2代表己内酰胺的摩尔质量。
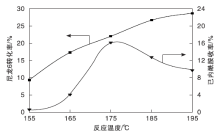
在m(尼龙6): m(催化剂): m (H2O)=1: 5: 3和反应时间8 h条件下, 考察反应温度对尼龙6水解反应的影响, 结果如图8所示。
由图8可知, 尼龙6转化率随着反应温度的升高逐步增加, 而己内酰胺收率先增大后减小, 这是由于在较低温度下, 升高温度使尼龙6在水中快速溶胀或溶解, 加大与水的接触面积, 与水之间的热运动加剧, 反应速率加快, 尼龙6转化率和己内酰胺收率都随之提高。但继续升高温度, 己内酰胺会因为高温不稳定分解, 造成收率下降。175 ℃时, 己内酰胺收率最高达到15.84%。因此, 选择175 ℃为较佳的反应温度。
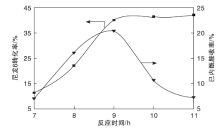
在m(尼龙6): m(催化剂): m (H2O)=1: 5: 3和反应温度175 ℃条件下, 考察反应时间对尼龙6水解反应的影响, 结果如图9所示。
从图9可以看出, 在(7~9) h, 尼龙6转化率和己内酰胺收率随反应时间的延长明显增加。9 h时, 尼龙6转化率和己内酰胺收率分别为40.00%和20.08%。继续延长时间, 尼龙6转化率基本保持不变, 而己内酰胺收率下降, 这说明在较高温度和过长时间下, 己内酰胺都会发生不可逆的复分解反应, 造成产率下降。因此, 选择9 h作为较佳的反应时间。
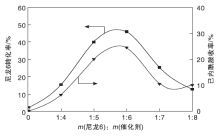
在m(尼龙6): m (H2O)=1: 3、反应温度175 ℃和反应时间9 h条件下, 考察催化剂用量对尼龙6水解反应的影响, 结果如图10所示。
由图10可知, 不加催化剂时, 尼龙6几乎不发生解聚反应。在m(尼龙6): m(催化剂)=1: 4~1: 6时, 尼龙6转化率和己内酰胺收率随催化剂用量的加大而增大, 在m(尼龙6): m(催化剂)=1: 6时, 尼龙6转化率和己内酰胺收率分别达到46.00%和24.56%。这是因为离子液体[Bmim]Br可与尼龙6分子链形成氢键, 破坏尼龙6分子链上酰胺键之间的氢键N— H…O=C, 有利于尼龙6在水中的溶解以及水分子对尼龙6分子链的进攻。继续加大催化剂用量, 尼龙6转化率和己内酰胺收率均下降, 这可能是因为过量离子液体使反应体系黏度增大, 阻碍了尼龙6分子与水分子的接触, 不利于反应的发生。因此, 选择m(尼龙6): m(催化剂)=1: 6为较佳的催化剂用量。
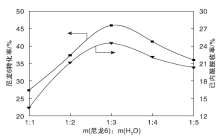
在m(尼龙6): m(催化剂)=1: 6、反应温度175 ℃和反应时间9 h条件下, 考察水用量对尼龙6水解反应的影响, 结果如图11所示。
从图11可以看出, 水用量对尼龙6水解反应的影响主要分两个阶段, 第一阶段, 在m(尼龙6): m(H2O)=1: 1~1: 3, 尼龙6转化率和己内酰胺收率随水用量的增多而增大, 最高分别达到46.00%和24.56%。第二阶段, 继续增加水用量, 尼龙6转化率和己内酰胺收率下降, 这是因为增大水用量, 使催化剂浓度降低, 催化活性降低, 不利于水解反应的进行。因此, 选择m(尼龙6): m(H2O)=1: 3作为较佳的水用量。
以离子液体[Bmim]Br为催化剂, 对尼龙6水解反应进行了研究, 并对固相产物和液相产物进行表征分析。结果表明, 固相产物为未解聚完全的尼龙6, 液相产物主要为己内酰胺。并获得了较佳的水解条件:m(尼龙6): m(催化剂): m (H2O)=1: 6: 3, 反应温度175 ℃, 反应时间9 h。此条件下, 尼龙6转化率为46.00%, 己内酰胺收率为24.56%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|