作者简介:张仕禄,1986年生,男,重庆市忠县人,硕士,实验师,研究方向为有机合成。
以4-苯基苯酚和4-叔丁基苯酚为原料设计合成杯芳烃片段桥连的吡唑基吡啶衍生物L1、L2,并采用1H NMR、13C NMR对其结构进行表征。结果表明,化合物L1作为配体, V (DMF)∶ V (水)=2:1为溶剂,在80 ℃时对钯催化Suzuki 偶联反应有良好的促进作用。
Two new pyrazolyl pyridine derivatives L1 and L2 connected by calixarene bridge were designed and synthesized by 4-phenyl phenol and 4- tert-butyl phenol.The structure of L1and L2 was ascertained by1H NMR,13C NMR. The study showed that L1 could accelerate Suzuki cross-coupling reaction in solvent with V (DMF)∶ V (水)=2∶1 at 80 ℃.
杂环化合物是现代医药、农药研究的重点, 吡唑吡啶类结构因具有较强的配位能力而备受青睐。吡唑吡啶类衍生物广泛应用于抗流感、农药中[1, 2, 3, 4]; 其Cu、Cd等过渡金属配位物在催化、材料、医药等领域也有重要应用[5, 6, 7]。邢永恒等[8]设计合成了Cd(Ⅱ )双苯吡唑基吡啶-草酸混配合物, 研究表明, 该类化合物对氧化环己烷有一定的催化作用。薛岳等[6]报道了2, 6-双吡唑基吡啶Cu(Ⅱ )配合物对环己烯的催化氧化反应, 且具有较好的立体选择性。杯芳烃作为第三代超分子化学研究的主体之一, 其衍生物在分子识别、催化、化学传感器、光电材料等领域有重要应用[9, 10, 11]。以杯芳烃片段为桥连的吡唑基吡啶衍生物的合成鲜有报道。本文以4-苯基苯酚和4-叔丁基苯酚为原料设计合成含有杯芳烃片段的吡唑基吡啶衍生物, 采用1H NMR、13C NMR对其结构进行表征, 并研究其对钯催化的Suzuki 偶联反应的促进作用。
ZFQ85A型旋转蒸发仪, 申科仪表有限公司 ; XT-4型双目显微熔点测定仪(温度计未经校正), 上海团结仪器制造有限公司; 400MHz核磁共振仪, Bruker公司; Agilent Teehnologies 7890A气相色谱。
联苯酚、叔丁基苯酚, 分析纯, 盐城创源化工有限公司; 2-吡唑基吡啶, 参照文献[12]合成; 氢化钠、1, 4-二氧六环、碘甲烷、三溴化磷、乙腈、甲醛、氢氧化钾, 均为分析纯, 成都科龙试剂厂。
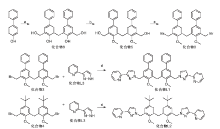
图1为化合物L1, L2的合成路线。
1.3.1 化合物6的合成[13]
在干燥的圆底烧瓶中加入15.3 g联苯酚, 75 mL甲醛溶液。冰浴环境搅拌下, 缓慢加入10.2 g氢氧化钾, 在40 ℃下搅拌8天。待反应结束后溶液呈黄色粘稠装液体, 用冰盐酸缓慢中和。过滤得白色固体10.72 g, 收率52%, 熔点(127~128)℃。
1.3.2 化合物5的合成[14]
将化合物6(7.5 g, 20 mmol), 碘甲烷(5 mL, 80 mmol), 无水碳酸钾(36 g)一起加入含有60 mL的无水乙腈的圆底烧瓶中, 在氮气氛环境中45 ℃搅拌12 h。待反应结束后, 用6 mol的HCl中和, 乙醚萃取合并有机相, 无水硫酸镁干燥, 经减压旋蒸得白色粉末状固体7.04 g, 收率80%, 熔点(114~116) ℃。
1.3.3 化合物3的合成
冰浴环境中, 将1.2 mL三溴化磷(12.6 mmol)缓慢注入45 mL含有5.5 g化合物5(12.5mmol)的无水1, 4-二氧六环中。然后室温搅拌24 h, 反应结束后用饱和碳酸氢钠调节溶液至中性, 乙醚萃取合并有机相, 经减压旋蒸得白色粉末状固体5.25 g, 收率93%, 熔点(98~99) ℃。
1.3.4 化合物4的合成
冰浴环境中, 将1.89 mL三溴化磷(20.0 mmol)缓慢注入60 mL含有4.0 g叔丁基苯酚杯芳烃片段(10.0 mmol)的无水1, 4-二氧六环中。室温搅拌24 h, 反应结束后用饱和碳酸氢钠调节溶液至中性, 乙醚萃取合并有机相, 无水硫酸镁干燥, 浓缩得白色粉末状固体4.87 g, 收率93%。熔点(101~102) ℃。
1.3.5 目标化合物L1的合成与结构表征
在氮气环境中向盛有0.2 g NaH 的圆底烧瓶中, 缓慢注入含有0.73 g的2-吡唑基吡啶(5 mmol)溶解于15 mL无水1, 4-二氧六环, 室温搅拌12 h。然后注入20 mL含有1.12 g 化合物3 (2 mmol)的无水1, 4-二氧六环。缓慢升温, 加热回流36 h。待反应结束后, 减压旋出1, 4-二氧六环, 残余物在冰浴环境中, 缓慢加入冰水卒灭过量的NaH 。用二氯甲烷萃取, 浓缩, 经石油醚∶ 乙酸乙酯=8∶ 1柱层析得白色粉末状固体0.95 g, 收率68%, 熔点> 200 ℃。
1H NMR(400 MHz, CDCl3):δ 3.778(s, 6H, -OCH3), δ 4.229(s, 2H, -CH2), δ 5.532(s, 4H, -CH2), δ 6.914(d, J=2.4, 2H, -ArH), δ 7.173-7.207(m, 2H, -ArH), δ 7.271-7.293(m, 3H, -ArH), δ 7.315-7.322(m, 3H, -ArH), δ 7.343-7.361(m, 3H, -ArH), δ 7.393-7.418(m, 4H, -ArH), δ 7.500-7.506(m, 2H, -ArH), δ 7.681-7.724(m, 2H, -ArH), δ 7.900-7.999(m, 2H, -ArH), δ 8.617-8.636(m, 2H, -ArH)。
13C NMR(100MHz, CDCl3):29.673, 51.340, 61.508, 104.719, 119.997, 122.201, 126.874, 127.315, 128.635, 129.648, 129.945, 130.912, 134.305, 136.408, 137.607, 140.040, 149.290, 151.625, 152.241, 155.806。
1.3.6 目标化合物L2的合成与结构表征
化合物L2的合成方法, 参照化合物L1 。得白色粉末状固体, 收率70%, 熔点> 200 ℃。
1H NMR(400MHz, CDCl3):δ 1.176(s, 18H, -C(CH3)3), δ 3.666(s, 6H, -OCH3), δ 4.102(s, 2H, -CH2), δ 5.453(s, 2H, -CH2), δ 6.888-6.894(m, 2H, -ArH), δ 7.040-7.086(m, 2H, -ArH), δ 7.175-7.190(m, 2H, -ArH), δ 7.194-7.206(m, 2H, -ArH), δ 7.409-7.415(m, 2H, -ArH), δ 7.690-7.734(m, 2H, -ArH), δ 7.952-7.974(m, 2H, -ArH), δ 8.617-8.634(m, 2H, -ArH)。
13C NMR(100MHz, CDCl3):29.590, 31.182, 34.211, 51.588, 61.280, 104.460, 119.920, 122.144, 128.340, 130.678, 133.095, 136.405, 147.149, 149.277, 151.389, 152.377, 154.168。
以溴苯和苯硼酸为模版反应研究化合物L1和L2对Suzuki 偶联反应的促进作用。根据文献[15], 在反应釜中加入1 mmol溴苯, 1.2 mmol苯硼酸, 2 mmolKOH, 0.1 mmol PdCl2, 0.1mmol四丁基氟化铵, 3 mL溶剂, 80 ℃反应24 h。反应结束后, 用二氯甲烷萃取3次, 产物含量经Agilent Teehnologies 7890A GC System测定。
表1为配体、溶剂对溴苯与苯硼酸的Suzuki偶联反应的影响。
| 表1 配体、溶剂对溴苯与苯硼酸的Suzuki 偶联反应的影响 Table 1 Effects of ligand and solvent on Suzuki cross-coupling reaction |
从表1可以看出, 只加入钯作催化剂也能发生一定的反应, 但产率只有40%。加入化合物L1、L2、L3作为配体产率均有较大幅度的提高, 但化合物L1效果最好, 产率达到80%。用V (DMF)∶ V(水)=1∶ 1作为溶剂时, 产率达到85%; 当V (DMF)∶ V (水)=2∶ 1产率达到90%; 采用纯DMF作溶剂产率最好93%, 但V (DMF)∶ V (水)=2∶ 1相对环保绿色。因此, 选用L1作为配体, V (DMF)∶ V (水)=2∶ 1作为反应体系溶剂。
参照文献[14], 在反应釜中加入1 mmol卤代芳烃, 1.2 mmol苯硼酸, 2 mmolKOH, 0.1 mmol四丁基氟化铵, 0.1 mmol配体L1, 溶剂3 mL[V (DMF)∶ V(水)=2∶ 1], 80 ℃反应24 h。反应结束后, 用二氯甲烷萃取3次, 产物含量经Agilent Teehnologies 7890A GC System测定。研究化合物L1对底物的普适性, 结果见表2。从表2可以看出, 碘代芳烃的活性相对较高(序号1~3); 芳环上含有供电子取代基和吸电子取代基都能取得较高的产率, 当含有吸电子基时产率优于供电子基(序号4~7); 当反应物为2-溴吡啶时产率较其他溴代芳香烃稍微有所降低(序号8)。
| 表2 化合物L1对Suzuki 偶联反应普适性结果 Table 2 Compound L1 for Suzuki cross-coupling reaction |
部分产物结构表征如下:
序号1:1H NMR(400MHz, CDCl3):δ 7.242(m, 2H, Ar-H), δ 7.351(m, 4H, Ar-H), δ 7.441(m, 4H, Ar-H)。
序号4:1H NMR(400MHz, CDCl3):δ 3.689(s, 3H, -OCH3), δ 6.914(m, 2H, Ar-H), δ 7.244(m, 1H, Ar-H), δ 7.351(m, 2H, Ar-H), δ 7.384(m, 2H, Ar-H), δ 7.485(m, 2H, Ar-H)。
序号5:1H NMR(400MHz, CDCl3):δ 7.302(m, 1H, Ar-H), δ 7.406(m, 2H, Ar-H), δ 7.515(m, 2H, Ar-H), δ 7.751(m, 2H, Ar-H), δ 8.302(m, 2H, Ar-H)。
序号6 :1H NMR(400MHz, CDCl3):δ 7.249(m, 1H, Ar-H), δ 7.326(m, 2H, Ar-H), δ 7.403(m, 2H, Ar-H), δ 7.504(m, 4H, Ar-H)。
序号7 :1H NMR(400MHz, CDCl3):δ 2.617(s, 3H, - CH3), δ 7.289(m, 1H, Ar-H), δ 7.398(m, 2H, Ar-H), δ 7.502(m, 2H, Ar-H), δ 7.603(m, 2H, Ar-H), δ 8.035(m, 2H, Ar-H)。
序号8:1H NMR(400MHz, CDCl3):δ 7.002(m, 1H, Ar-H), δ 7.243(m, 1H, Ar-H), δ 7.357(m, 2H, Ar-H), δ 7.451(m, 1H, Ar-H), δ 7.498(m, 1H, Ar-H), δ 8.013(m, 2H, Ar-H), δ 8.716(m, 1H, Ar-H)。
以联苯酚和叔丁基苯酚为原料, 设计合成了新型以杯芳烃片段为桥连的吡唑基吡啶衍生物L1和L2, 以L1为配体, V (DMF)∶ V (水)=2∶ 1为溶剂, 对钯原位催化Suzuki 偶联反应有良好的促进作用。在最优实验条件下对不同取代基的卤代芳烃都有良好的产率、实验条件温和。表明该类配体在工业上具有广阔的应用前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|