作者简介:喻兰兰,1995年生,女,硕士,研究方向为环境与能源催化材料。
氨是一种重要的化工原料,主要通过传统Haber-Bosch工艺制备,该工艺有一定局限性,如耗能高,污染大,对环境造成较大影响。以氮气为原料,在常温、常压下合成氨气是目前化学领域的研究热点之一。分析几种产氨方法,其中电催化还原氮气产氨具有良好的应用前景。介绍电还原产氨原理及目前较为常用的电催化剂贵金属催化剂、非贵金属-金属催化剂和非金属催化剂,并对目前该领域遇到的挑战进行总结。
As an important chemical raw material,ammonia is mainly produced by the traditional Haber-Bosch process,which has certain limitations such as high energy consumption,severe pollution,and negative impacts on the environment.The synthesis of ammonia from dinitrogen at ambient temperature and pressure is one of the most attractive highlights in the field of chemistry.In this review,several methods of ammonia production are introduced,among which electrocatalytic reduction of nitrogen to ammonia shows good application.The mechanisms of electrocatalytic ammonia production are also introduced firstly,and then three kinds of electrocatalysts commonly used are described,including precious metal catalysts,non-precious metal-based catalysts and non-metal catalysts.Finally,the challenges are outlined in this emerging field.
NH3不仅是一种重要的储能中间体和无碳能源载体, 也是生产尿素及硝酸等化工产品的重要原料。目前, 全球每年NH3产量约1.5亿吨, 随着世界人口的快速增长, 对NH3的需求不断增加。空气中78%的成分为N2, 结合环境中的氮循环, 人们对N2到NH3的转换过程产生极大兴趣。然而, N2化学性质很稳定, N≡ N三键键能很强, 所以不能直接进行大多数化学反应。工业上NH3的生产仍然以一百多年前发展起来的Haber-Bosch工艺为主[1], 该工艺是以铁或钌基材料作催化剂, 使用高纯度N2和H2流在高温(500 ℃)和高压[(20.26530.397) MPa]下进行。制备过程的反应式[2]为:N2+3H2→ 2NH3。
目前工业制氨过程消耗的能源占世界能源供应的1%以上[3], 每年产生的二氧化碳相当于3亿吨化石燃料燃烧产生的二氧化碳量[4]。因此, 为了克服Haber-Bosch工艺高能耗、高碳排放及复杂的工厂设备等局限性, 开发绿色可持续产氨工艺十分必要。
催化剂是合成氨反应中的关键。自从氨首次被工业合成, 许多研究人员就一直致力于开发能在常温、常压下发挥作用的催化剂, 发现很多植物可以通过根部固氮酶将空气中的N2转化成氮肥, 为自身生长提供营养成分, 而这一过程正好是在常温、常压下进行。进一步研究分析表明, 固氮酶中主要含有铁蛋白和钼铁蛋白, 这两种物质在N2还原过程中起关键的催化作用。因而, 人们通过模拟植物固氮过程, 开发出一些如钼、铁和钴的氮化合物, 用于常温、常压下将N2还原为N
本文阐述电催化还原氮气机理, 介绍近些年来电催化固氮的催化剂, 综述电催化还原氮气过程中遇到的挑战[7]以及针对这些问题所做的研究工作。
电催化固氮(NRR)反应装置[8]由电解槽、电解液、阴阳两极和离子交换膜组成。实验过程中, 在两极施加一定电压, 阴极负载催化材料, 并在阴极室通入高纯度N2, 使之吸附在催化剂上, 在催化剂作用下, N2在阴极发生还原反应生成NH3。阳极发生氧化反应, 水被氧化后会在阳极生成氧气, 反应式为:2N2+6H2O→ 4NH3+3O2。
电催化还原N2机理较为复杂, 一般认为, N2还原为NH3的机理包括解离途径和缔合途径。解离途径(图1a)中, N2的N≡ N三键断裂后, 分别在N原子上进行加氢; 缔合机理中, N2分子与催化剂表面结合, 直接在N2分子上进行加氢。NH3分子只有在最终的N≡ N键断裂后才生成。根据不同加氢顺序, 可将缔合途径进一步分为远端路径和交替路径。远端途径中, 氢化优先发生在离催化剂表面最远的N原子上, 导致一个NH3分子的释放, 然后继续氢化生成另一个NH3分子[9]; 交替途径中, 催化剂表面的两个N原子交替进行加氢, 第一个NH3分子释放后, 第二个NH3分子随之释放(图1b)。值得注意的是, 酶途径属于缔合途径中的交替途径, 且具有N原子侧向吸附模式的显著特征(图1c), 而非大多数非均质表面提出的N原子端向吸附模式。
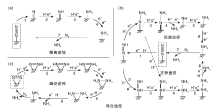 | 图1 催化N2转化为NH3的解离途径和缔合途径(包括远端、交替和酶促途径)示意图[10]Figure 1 Schematic depiction of the dissociative pathway and the associative pathways(including distal, alternating, and enzymatic pathway) for catalytic conversion of N2 to N |
缔合和解离机制仍存在争议, 不同催化剂对NRR的反应机制可能有不同。
催化剂是电催化还原氮气系统的核心物质[11]。目前文献中报道的主要催化剂分为贵金属催化剂、非贵金属-金属催化剂和非金属催化剂。
贵金属主要指Au、Ag和铂族金属(Ru、Rh、Pt、Os、Ir、Pt)等8种金属元素。贵金属因其对多种反应物具有较强的结合性和良好的导电性而被广泛应用于各种反应的电催化剂中。近年来, 它们也作为NRR电催化剂用于NH3生产。NRR最广泛开发的稀有材料有Ru12]、Rh[13]、Au[14]和Pt[15]。
Kordali V M等[12]在常温下, 以0.05 mol· L-1的RuCl3溶液为原料, 用电化学沉积法将Ru负载于碳毡上, 在固相聚合物电解质(SPE)中用作NRR电催化剂。当外加电压为-1.10 V时, 以水和N2为原料, 基于Ru的SPE电池产生NH3的速率为0.21× 10-6 g· cm-2· h-1, 法拉第效率0.28%。低NH3产率和电流效率是基于Ru的SPE电池的主要局限性。为了改善Ru电催化剂的NRR性能, 需要通过调整电化学沉积条件, 如调节电位/电流、沉积时间和电解质组成等, 或改善Ru电催化剂的纳米结构和表面缺陷位点增加活性位点密度[9]。
Kugler K等[13]提出了一种在钛毡上制备Rh和Ru镀层的简便、高效方法。Rh镀层硬度高, 耐磨性好, 耐腐蚀。根据Skú lason E等[16]的报道, Rh和Ru对电化学氨合成的催化活性相当。Rh和Ru的电流效率很高, 分别达到93.8%和98.7%。采用线性扫描伏安法测定了电化学氨合成过程中Rh和Ru涂层的活性。结果表明, 采用Ru涂层时, 电解质中N
Wang H J等[17]提出一种直接在泡沫镍表面制备多孔金膜(pAu/NF)的胶束辅助电沉积方法。受益于其相互连通多孔结构设计, 制备的pAu/NF显示出优越的NRR性能, 在中性电解质(0.1 mol· L-1的Na2SO4)中, -0.2 V(vs. RHE)下, NH3产率为9.42 μ g· h-1· cm-2, 法拉第效率高达13.36%, NH3产率高于24面体金(Au)纳米棒(1.648 μ g· h-1· cm-2)[14]。pAu/NF材料具有良好的催化性能, 得益于制备过程中采用自支撑法负载金纳米棒的办法, 而非用黏合剂进行负载。因为在合成过程中使用的表面活性剂分子夹在催化剂与载体之间, 一定程度上影响电子的传输, 也很可能覆盖在催化剂表面, 导致活性位点受阻。因此, 采用自支撑的方法而不用黏合剂, 表面活性剂分子从材料表面去除, 可以加快电子传输速度, 提高活性位点密度, 提升催化性能。此外, 制备其他纳米结构的金材料, 如超薄二维纳米薄片金材料, 可能有助于提高活性位点密度。
Lan R等[15]以工业铂电催化剂, 在正极和负极负载1 mg· cm-2铂, 经N
与贵金属相比, 非贵金属尤其是过渡金属材料具有价格低廉和储量丰富的特点。近年来, 研究者在常温、常压下, 将非贵金属包括Mo、Ni、Ti、Fe、Zn、Cu、Sn、Sb、Pb及其氧化物、硫族化合物和硼化物等作为NRR的电催化剂, 进行了大量研究。
Ren X等[18]报道了酸性电解液中, 环境条件下, Mo2N纳米棒作为一种高效、高选择性的NRR电催化剂固定氮气的研究。在0.1 mol· L-1的HCl中, 法拉第效率为4.5%, NH3产率为78.4 μ g· (h· mg-cat)-1。在常温、常压下, 选择性高, 电化学耐久性好。DFT计算表明, 氮化后, 在MoO2上的氮还原电位测定步骤的自由能垒显著降低。这项工作不仅将Mo2N纳米棒作为高效稳定的NRR电催化剂, 而且为低成本过渡金属作为NRR催化材料在许多新应用领域的发展开辟了新方向。
Fe是一种化学性质稳定及价格低廉的金属元素。光谱研究表明, Fe是固氮酶中的钼铁蛋白结合N2所必需的过渡金属原子[19]。Li X等[10]提出了以嵌有FeN3的石墨烯为固氮催化剂, 结果表明, 从化学配位角度看, FeN3中心具有明显的自旋极化和局域磁矩, 可以促进N2吸附, 激活其惰性的N≡ N三键。石墨烯与FeN3之间的协同作用使该体系具备新特性, 可以在室温下通过3种可能的反应途径, 通过六质子和六电子的过程催化活化N2转化为NH3。
TiO2作为一种含量丰富、无毒的物质, 成为光化学研究热点之一。Wang Y等[20]研究表明, TiO2纳米薄片阵列对NRR有活性, 且TiO2掺杂硼后, NH3产率更高, 为14.4 μ g· (h· mg-cat)-1, 法拉第效率为2.5%。主要原因是硼掺杂后会形成氧空位, 使TiO2半导体性质转变为半金属性质, 进而促进TiO2的电化学性能, TiO2电导率有所增强[21], 为设计价格低廉及催化性能优良的固氮催化剂提供了思路。
以贵金属为原料的NRR催化剂活性较好, 但由于原料的稀缺性和成本较高, 限制了其使用范围, 非金属材料具有价格低廉和分布广泛的特点。与金属材料对比, 非金属催化材料可以避免金属离子的释放, 减少对环境的污染。
近年来, 碳基材料表现出优异的催化活性和良好的抗CO中毒性, 成为取代贵金属作为氧还原电催化剂的先行者[22]。由于碳材料主要由碳组成, 甚至可以直接由生物质制成, 因此具有较好的可持续性[23]。N掺杂多孔碳在电化学还原领域引起广泛关注, 其表面积大, 孔隙丰富, 可暴露大量活性位点, 可供反应物及中间产物进行快速传质。N掺杂调节了碳纳米材料的电子结构, 并诱导缺陷的形成和电荷极化, 增强了对O2电催化活性和吸附能力以及对CO2还原性能[24]。刘艳明等[25]报道了N掺杂多孔碳作为一种经济有效的电催化剂, 在常温、常压下电催化N2还原制NH3, 并通过调节N含量和N种类, 增强了N2化学吸附和N≡ N三键裂解。结果表明, 该方法能有效将N2固定转化为NH3, 在-0.9 V(vs. RHE)下, NH3产率为1.4 mmol· (g· h)-1。结合密度泛函理论计算表明, 材料中的吡啶氮和吡咯氮是合成氨的活性位点, 其含量对促进N掺杂多孔碳的产氨效率具有重要意义。
Qiu W B等[26]研究表明, B4C纳米薄片作为一种极好的无金属电催化剂, 常温、常压下对人工N2固定转化成NH3具有极好的选择性。在0.1 mol· L-1盐酸和-0.75 V(vs. RHE)下, 能够实现平均26.57 μ g· (h· mg-cat)-1的NH3产率和15.95%的法拉第效率, 成为最具活性的非金属NRR电催化剂之一。此外, B4C纳米薄片还具有很高的电化学稳定性, 在0.1 mol· L-1盐酸硫酸钠电解液中, NH3产率14.70 μ g· (h· mg-cat)-1, 表现出良好的活性和选择性。
目前NRR存在的主要问题是NH3产率和法拉第效率均很低, 缺乏有效的电化学固氮产氨的电催化剂。研究发现, N2转化成NH3的理论电位和析氢反应的相近。在N2还原过程中, 阴极发生的析氢反应会与固氮反应争夺氢离子, 形成竞争反应, 进而降低了固氮效率, 因而, 材料的设计要考虑对两种还原反应的选择性。目前为止, 主要通过调节优化催化材料的组成和结构以及抑制析氢反应两个方面提高电催化还原N2的效率。析氢反应的反应式为:2H++2e-→ H2。
为了提高电催化剂的固有催化活性和对NRR的选择性, 需要对其进行合理的设计。在材料组成方面, 可以将性能良好的单原子材料进行复合, 形成复合材料。Hu L等[27]报道了一种用于环境电化学氨合成的Fe/Fe3O4催化剂, 300 ℃下氧化Fe箔, 然后进行原位电化学还原制得该催化剂, 在-0.3 V(vs. RHE)下, 磷酸盐缓冲液中产NH3的法拉第效率为8.29%, 约是原始Fe箔的120倍。与Fe箔相比, Fe/Fe3O4催化剂对NRR固有活性提高了9倍, 并有效抑制了HER活性, 从而增强了选择性。Fe/Fe3O4催化剂的NRR选择性也高于Fe、Fe3O4和Fe2O3纳米颗粒, 表明Fe/Fe氧化物复合材料是环境电化学氨合成的有效催化剂。
在材料制备过程中掺杂N、S、C和P等非金属元素的方法对提高材料的固氮效果有明显的优势。非金属杂原子掺杂(如O、B、N、P、S)可以调节碳原子的电子结构, 为提高电催化性能提供了一种有效的方法[28]。Mukherjee S等[29]报告了一种金属有机骨架衍生的氮掺杂纳米孔碳作为NRR的电催化剂。在室温、常压和-0.3 V(vs. RHE)下, 0.1 mol· L-1的KOH电解液中NH3产率3.4× 10-6 mol· cm-2· h-1, 法拉第效率10.2%。将温度提高至60 ℃, NH3产率进一步提高至7.3× 10-6 mol· cm-2· h-1。传统NRR催化剂使用的是氮化物和氧化物, 而从氮掺杂和碳缺陷良好的多孔锌基沸石咪唑框架前驱体中制备的碳催化剂可以为设计高效的氨电化学合成催化剂提供新的思路。
此外, 对催化材料的结构和形貌进行调控也是提高反应活性的一种办法。Han J G等[30]制备的纳米纤维状Nb2O5是一种优越的非贵金属电催化剂, 将其负载在碳纸上, 可以在室温、常压下进行人工固氮反应。-0.55 V(vs. RHE)下, 在0.1 mol· L-1 的HCl中, NH3产率达43.6 μ g· (h· mg-cat)-1, 法拉第效率为9.26%。Nb2O5纳米纤维具有较高的选择性和良好的电化学稳定性。因其具有高孔特性, 不仅有利于N2及其产物的扩散[25], 而且暴露出更多能够有效接触碳纸表面的活性位点, 为更高效的N2还原电催化提供了丰富的N2、电解质和催化剂的三相接触点[31]。
在析氢反应中, 最初H+吸附在活性位点的过程由电子转移实现, 因此, 调节催化剂、基底、电解质的物理性能是限制HER的关键。
Suryanto B H R等[32]选用具有半导体性质的Ru/2H-MoS2催化剂, 通过抑制HER提升NRR性能。由于H+/H2的氧化还原电位位于2H-MoS2的导带能级之上, 所以2H-MoS2具有抑制HER速率的作用。该电催化剂在50 ℃时法拉第效率达17.6%, NH3产率1.14× 10-10mol· cm-2· h-1, 表明Ru/2H-MoS2是电催化还原氮气领域中性能很好的一种材料。
根据Singh A R等[33]分析, 限制催化剂表面的质子或电子的可用性对于抑制HER和改善NRR选择性是一个很有前景的方法。他们的定性模型表明, 在正常质子浓度下, 金属表面之外, HER应该始终处于主导地位。如果提供的质子或电子很少, NRR会优先发生。这一假设与最近的实验研究一致。最近已经证明了一种很有前景的策略— — 通过精心设计催化剂/电解质表面抑制HER。Chen G等[34]设计了一种用于固氮的Li+掺杂聚合物(N-乙基苯-1, 2, 4, 5-四羧基二亚胺)(PEBCD)的材料。PEBCD中含有一定量的氧原子, 氧原子是吸附氢原子的最佳活性位点, 而Li+的加入可以取代氧原子位置, 抑制HER, 使NRR性能提高。
氨在现代农业中起着重要的作用, 由于具有可压缩性、高能量密度和零碳排放的特点, 氨有潜力成为未来能源格局中的中心分子。电催化还原氮气的研究对生态环境和新能源的开发非常重要, NRR领域的进展证实了常温、常压下使用电催化方法, 在非均相表面上将N2还原为NH3的可能性。但电催化还原N2的研究仍处在实验室阶段, 这主要是因为催化剂对N2的选择性极低, 从而导致NH3产率较低。尽管存在很多挑战, 但结合理论和实验研究, 将会发现更多高效稳定、更具选择性的固氮电催化剂, 最终实现电催化产氨的工业生产。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|


