作者简介:方欢乐,1981年生,女,硕士,讲师,主要从事心血管药物研究。
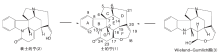
士的宁属于单萜吲哚生物碱,是中药马钱子的主要有效成分,具有复杂的化学结构,包含7个环系和6个手性中心。Woodward经典合成代表了有机合成领域的里程碑。经过半个多世纪的努力已有十几个科研小组以不同策略对士的宁分子进行全合成,丰富和发展了有机合成工艺。士的宁是试验新反应和新合成策略的重要目标。按照成环方式对单萜吲哚生物碱士的宁的多种合成途径进行了总结,以促进相关研究。
Strychnine,a well-known monoterpenoid indole alkaloid which existed in a traditional Chinese medicine, Strychnos nux- vomica,has generated considerable attention among synthetic chemists mainly because of its architecturally complex structural features,including the unique heptacyclic framework as well as the six contiguous chiral centers. The classical total synthesis of strychnine by Woodward represented a milestone in the field of organic synthesis.More than ten research groups have succeeded in synthesizing this mythical molecule up to now.Strychnine remains a popular target for demonstrating new reactions and novel synthetic strategies. In this paper,the synthetic methods are reviewed according to the key building reactions of the ring structures.
马钱子临床应用广泛, 中医采用炮制和配伍等策略来降低毒性保障安全[1, 2, 3, 4, 5, 6]。士的宁(1)属单萜吲哚生物碱类, 是中药马钱子的主要有效成分, 也是有毒成分。士的宁具有镇痛、抗炎、抗肿瘤作用, 系中枢递质甘氨酸的拮抗剂, 对脊髓有高度的选择性兴奋作用[7]。1818年, Pelletier等从植物马钱子中分离出士的宁, 作为人类得到的第一个纯生物碱, 其分离成功且有划时代意义。1838年Regnault给出正确的分子组成, 通过化学降解方法完成。由于其7环复杂结构极大的挑战了经典化学降解法, 因而从19世纪80年代开始的化学降解工作一直到1946年才由Robertson完成[8]。Woodward R B等[9]1948年也给出了士的宁结构。通过XRD确定其相对构型[10]及绝对构型[11]。士的宁分子中包含7个环和6个手性中心, 是结构最为复杂的天然产物之一, 因而对合成化学具有极大的挑战。合成士的宁不仅可以解决来源问题, 也可以为结构修饰和构效关系研究打下良好基础。士的宁合成最早开始于1948年Woodward R B等[12]设计, 并于1954年完成。用表士的宁构建士的宁的F环和G环。1992年, Magnus P等[13]报道了士的宁全合成, 首次用Wieland-Gumlich醛实现了F环和G环的构建。由Woodward R B和Magnus P建立的构建G环和F环的合成策略被广泛采用。到2011年先后有多个科研小组分别以不同合成路线得到表士的宁(2)或Wieland-Gumlich醛(3), 并最终合成士的宁。从结构上分析全合成士的宁有4个关键问题需要解决:(1) C-7位季碳中心的建立; (2) CDE环的构建及环系间相对立体化学的确定; (3) C-20的羟亚乙基的形成; (4) 通过表士的宁或Wieland-Gumlich醛构建G环和F环。
本文按照成环方式对单萜吲哚生物碱士的宁的合成进行研究。合成编号顺序如图1所示。
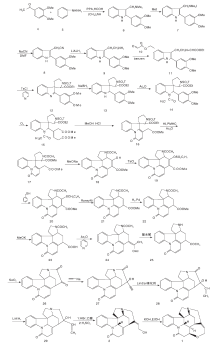
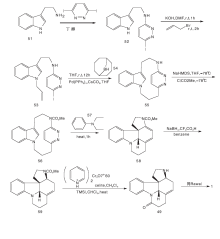
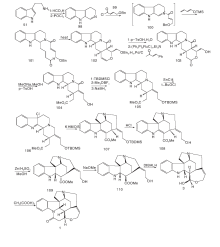
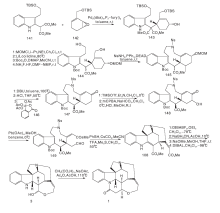
Woodward R B于1954年首次合成了士的宁[12]。这一工作对于现代有机化学具有里程碑意义, 是现代有机合成黄金时代的开端。士的宁合成路线如图2所示。在此之前, Prelog V等[14]报道了表士的宁转化成士的宁的方法, 因此Woodward R B选择这一方法来构建F-环。以3, 4-二甲氧基苯乙酮4和苯肼5为原料, 经PPA、甲醛和二甲胺反应形成6。6经甲基化、氰化及还原得到9。9和乙醛酸乙酯反应形成Schiff碱11。经对甲苯磺酰氯(TsCl)环化得到具有ABC环系的关键中间体12。12经还原、N酰化及O3选择性氧化得到15。15在盐酸甲醇液中关环形成具有ABCG环系的16。16经过变换19位N上的保护基及分子内的Dieckmann缩合反应生成18。18经甲苯磺酰化、形成硫醚和活性降低的Raney Ni脱硫反应, 脱去18上的— OH形成21, 再经还原、与酸酐反应放出CO2及酸水解生成25。25经SeO2氧化生成26。26经乙炔化等4步反应生成表示宁2, 在醇性KOH作用下生成(± )-士的宁。
Kuehne M E等[15]于1993年以13步反应完成了消旋士的宁合成, 合成线路如图3所示。以30和31为原料在甲苯中回流, 经BF3· Et2O催化缩合一步合成含ABCE环系的关键中间体32。32经HClO4在室温下水解得到33。33和Me3SiI及ButLi反应得到34和35。35不经分离继续回流得到含有D环的36。36经还原、乙酰化得到40。将40加入THF中, 用过量的LiN(SiMe3)2关环得到含有G环的41。41经NaBH3CN还原、乙酸酐酰化得42。42与DBU在二氧六环中加热得43, 再经Swern氧化、Wittig-Horner缩合得表士的宁前驱体45。45的酯经二异丁基氢化铝(DIBALH)还原得2。2在醇性KOH作用下生成(± )-士的宁。
Rawal V H等[16]以15步合成路线于1994年完成了消旋士的宁全合成, 如图 4所示。以邻硝基苯乙腈46为原料, 经过7步反应制备中间体47。密封管中以苯为溶剂进行Diels-Alder反应, 以99%收率得到含有ABCE环系的关键中间体48。48经N脱保护, 分子内酰胺化得到含有G环的49。碱性条件下49与碘代乙烯51通过Heck反应得到50。50经LiAlH4还原并在HCl催化下双键异构化并脱去保护基得到2, 最后经KOH作用得到(± )-士的宁。
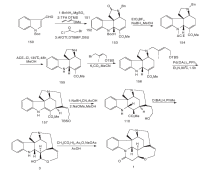
Bodwell G J等[17]以色胺51为原料, 用IEDDA反应合成消旋士的宁, 如图5所示。
51与3, 6-二碘哒嗪反应生成碘化物52, 然后与溴丙乙烯和KOH在DMF中反应得到烷基化产物53, 分子内的Suzuki偶联生成55。对55的N进行保护得到56, 然后在N, N-二乙基苯胺57作用下发生关键的跨环IFEDDA反应, 得到含有ABCEG环系的关键中间体58。用NaBH4/CF3COOH还原58得到59, 经吡啶重铬酸盐60氧化得到Rawal路线中的关键产物49, 然后同Rawal路线得到(± )-士的宁。
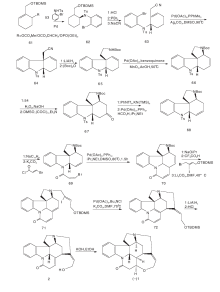
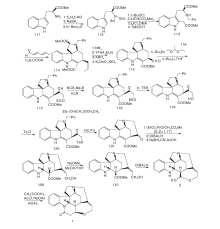
Nakanishi M等[18]以61和53为原料经过Pd不对称催化取代反应得到62。62经氰基化、环化得到64。64氰基经过还原、Boc保护, 最后关环得到含有ABCE关键中间体66。66经过4步反应关环得到含有G环的双键转移化合物70, 与碘代乙烯51反应, 脱去Boc保护, 并通过分子内Heck反应得到含有D环的72。72经LiAlH4还原并在HCl催化下双键异构化并脱去保护基得到2, 最后经过KOH作用得到(-)-士的宁, 合成路线如图6所示。
Eichberg M J等[19]以51为原料, 对氨基进行酰化保护, 用73在相转移条件下对吲哚环上的N进行烷基化得到74。74在CpCo(C2H4)2的介导下发生分子内[2+2+2]环化加成得到含有ABEG环的关键中间体75。75在KOH作用下脱去氨基上的保护基得到76, 在Fe3+作用下脱去CpCo片段并关环形成含有C环的内酰胺49。49为Rawal合成路线关键中间体, 经分子内的Heck反应等一系列过程生成(± )-士的宁1, 合成路线如图7所示。
 | 图7 分子内Heck反应等过程生成(± )-士的宁路线Figure 7 Route of (± ) - strychnine formation by intramolecular Heck reaction and other processes |
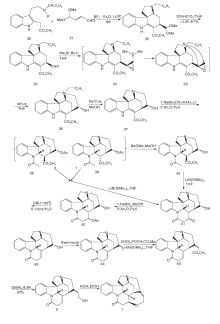
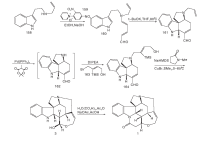
Beemlmanns C等[20]以77为原料, 在HMPA存在下用SmI2催化发生分子内环化缩合及酰化生成含有ABEG环系的关键中间体78。甲醇溶液中用Raney Ni催化还原分子内关环生成含有C环的79。79经N保护、脱羟基等一锅反应生成80。80与碘代乙烯衍生物反应, 经分子内Heck反应生成与Rawal合成路线中50类似的82。随后用与Rawal合成相同的方法得到(± )-士的宁, 如图8所示。
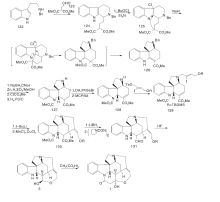
Magnus P等[13]以51为原料与α -酮基戊二酸甲酯发生mannich反应, 酰胺化得到83。83的酰胺通过Lawesson试剂转变为硫酰胺再经Raney Ni还原脱硫得到84。84经酰化、开环得到甲酰三氯乙酯保护的85。对85的吲哚N用氯甲酸甲酯保护, 然后用Zn粉脱去甲酰三氯乙酯保护, 再与α -苯硫醚乙酸反应, 最后经m-CPBA氧化得到86。86在强碱作用下发生Michael加成, 在三氟乙酸和HgO作用下得到含有ABD三环系的88。88经过缩酮保护、酰胺还原和吲哚N脱保护后得到形成EC环的关键中间体89。89经过分子内亚铵盐亲核加成反应得到含有ABDEC五环系的91。91经锌粉还原、MeONa异构化得93。对93吲哚环上的N再次用对甲氧基苯磺酰氯保护, 用LiBH4还原酯基, 最后用高氯酸脱去缩酮保护得94。94通过开环、羟基保护和Wittig反应得顺反异构混合中间体95。对95的氰基进行两步还原直接得到C-20位含有亚乙基醇的中间体96。96上的三异丙基硅保护基经HCl脱去然后再用叔丁基二甲基硅选择性保护C-20位的羟基得到97。97游离的羟基经吡啶-铬酐氧化成醛后与脱去保护基的C-20位的游离羟基进行关环反应得到了3。3上吲哚N的保护基脱去后与丙二酸缩合得到(± )-士的宁, 合成路线如图9所示。
Ito M等[21]以51为原料与甲酸发生Bischler-Napieralski反应生成98。98与99反应再与丁二烯衍生物发生亲核加成生成α , β 不饱和醛101。101经加热发生分子内关环反应得到含有ABD环系的关键中间体102。水解102烯醚键、氧化及还原去除苄基保护得到内酯103。103在MeONa作用下发生β 消除反应得到104。对104游离羟基进行保护, 用NaBH4选择性还原酰胺羰基得到105。在SnCl4存在下与t-BuOCl反应得到106。106与六甲基二硅基胺基锂LHMDS反应得到含有ABDEC环的关键中间体107。107在HCl作用下脱去C-20位羟基上的保护基然后经过一系列构型转换最后经DIBALH及NaBH4还原关环得到3。3上吲哚N保护基脱去后与丙二酸缩合得到(± )-士的宁, 合成路线如图10所示。
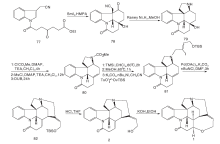
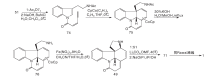
Kuehne M E等[22]于1998年完成光学纯士的宁合成, 以色氨酸111为原料经氨基苄基和Boc保护、吲哚环烷基化再脱Boc保护等7步反应得113。对甲苯磺酸催化与己二烯醛发生Mannich加成、缩合、开环、再缩合四步串联式一锅反应制备含ABCE四环体系的关键中间体114。114经脱羧及双键断裂得到115, 与116发生加成并经N-氯代丁二酰亚胺NCS氧化生成118。118脱去EE保护基转化为易离去的对甲苯磺酰基后与苄胺形成季铵盐, 然后加氢生成含有D环的关键中间体121, 通过Wittig反应, DIBALH还原酯基及NaBH3CN还原共轭双键得到Martin合成路线中的化合物109, 再依Martin反应得到(-)-士的宁, 合成路线如图11所示。
Stork G[23]合成方法与Kuehne基本相同, 不同之处是形成D环时C-15与C-20关环, 而Kuehne则是在C-20与N-4之间关环。Stork首次使用了碘代乙烯化合物构建D环, 这一方法被后来许多科研小组应用。Stork以色胺为原料, 经苄基保护后与123发生Pictet-Spengler缩合得到124。124用t-BuOCl氧化后与NaH反应一步得到关键中间体126。然后用Zn粉或NaBH3CN还原126, 用氯甲酸甲酯对吲哚N进行保护, 最后加氢脱苄基得127。127经两步反应生成C15-C16不饱和双键, 然后与碘代乙烯衍生物反应生成α , β 不饱和酯129。129在正丁基锂、MnCl2和CuCl2作用下发生分子内Heck反应关环形成关键中间产物130。将130还原成醛并脱去吲哚N上的保护基得131。131经HF作用游离出C-20上的羟基并关环得到3。3与丙二酸缩合得到(± )-士的宁, 合成路线如图12所示。
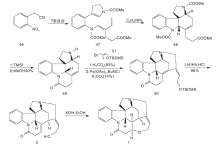
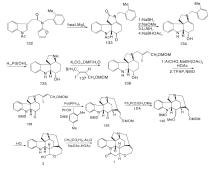
Zhang H等[24]以化合物132为原料, 与MgI2加热发生分子内[4+2]环加成反应, 经重排得到含ABEC环的133。133经NaBH4选择性还原N-4内酰胺的羰基, 在NaOMe作用下脱去吲哚N上的乙酰基, 还原酮羰基得到中间体134。134经氢解脱去4位N上的保护基, 与碘代乙烯化合物反应得到136。136与2, 4-二甲氧基苯甲醛反应生成亚胺, 用NaBH(OAc)3还原得到胺, 被四正丙基过钌酸铵氧化得到138。经Pd催化发生分子内Heck反应生成含有D环的139。在LDA与Ph2P(O)CH2OMe作用下将139羰基转变成烯醚基, 再经酸化关环得到3。3与丙二酸缩合得到(± )-士的宁, 合成路线见图13。
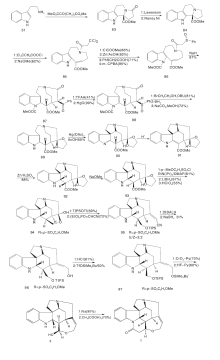
Kaburagi Y等[25]在Pd催化下141和142偶合得到143。143经MOM羟基保护、去甲酸甲酯、吲哚N的Boc保护及去TBS保护四步反应得144。144与NsNH2反应关环得到化合物145, 经Dess-Martin氧化得147。147经Rubottom氧化得羟基酮148, 经氧化开环得含有醛基和不饱和酯基的149。在PhSH、Cs2CO3条件下脱去4位N上的Ns基团, 分子内关环形成含有ABCDE环的108。其他反应同Kuehne合成路线, 得到(-)-士的宁, 合成路线如图14所示。
Sirasani G等[26]以150为原料, 跟苯胺、151及152发生Mannich反应, 再与2, 6-二叔丁基-4-甲基吡啶DTBMP和DBU反应生成含有ABCE环系的关键中间体153。153的内酰胺被还原得到154。在ACE-Cl作用下除去吲哚N上的基团和4位N上的苄基保护得155。155与碘代乙烯衍生物反应然后经Pd催化的分子内Heck反应得到157。157经NaBH3CN还原C2-C16的双键, 除去C20位保护基得到游离羟基化合物110, 然后依Martin路线得(± )-士的宁, 合成路线如图15所示。
2011年, Martin D B C等[27]以6步反应完成消旋士的宁合成。158在NaOH醇溶液中与159反应生成Zincke醛, 然后在碱性条件下发生分子内Diels-Alder反应生成关键中间体161。161经Meldrum酸及Pd(PPh3)4作用, 4位N上的烯丙基脱掉生成162, 在N, N-二异丙基乙胺(DIPEA)存在下与163反应生成164。164在六甲基二硅基氨基钠(NaHMDS)和N-甲基吡咯烷酮条件下发生Brook重排, 使得TMS基团转移到164游离的羟基上, 然后在CuBr、SMe2条件下发生分子内Heck加成反应生成3。3与丙二酸缩合得到(± )-士的宁, 合成路线如图16所示。
作为结构复杂、生物活性较强的天然产物士的宁, 吸引科学家对其研究已进行了近两个世纪, 至今仍是研究热点。士的宁合成从1954年Woodward以二十多步反应到2011年Martin仅以6步反应实现, 经历了半个多世纪历程。士的宁是众多单萜吲哚生物碱当中的重要一元, 这类生物碱因其结构多样性和重要的生物活性, 一直吸引着天然产物化学家、合成化学家、药物化学家等对其进行深入广泛地研究。对这些生物碱的合成研究不仅能够得到多样性化合物, 为生物活性评价及构效关系研究提供样品, 为理解这些化合物的生物合成机制提供信息, 同时也能促进有机合成方法学的进步。因此, 这仍然是一个很有吸引力的研究领域, 相信会有更多更好的成果出现。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|