作者简介:杨盼盼,男,博士。
对自主研制的甲醇合成催化剂进行工艺参数优化,同时根据实验结果对合成气条件下甲醇合成的反应机理进行探讨。实验采用16通道反应器,考察反应温度和接触时间对合成甲醇反应速率的影响,确定适宜的催化剂工艺条件。结果表明,在较长接触时间下,随着温度的升高,CO转化率、H2转化率和甲醇相对含量先升高后降低,CO2转化率降低。在较低温度下,CO2转化率随接触时间延长基本不变,表明甲醇中碳元素主要来自于CO,而CO2浓度处于水汽变换反应与加氢形成甲醇反应之间的平衡状态。
The process parameters of a self-designed methanol-synthesis catalyst were optimized and reaction mechanisms involved were investigated.The effect of reaction temperature and contact time on reaction rate was studied in reactor with 16 channels,and the suitable process conditions were obtained.Results showed that with high contact time,conversions of CO and H2,and relative content of CH3OH increased and then decreased when reaction temperature increased,while CO2 conversion decreased gradually.Under low temperature,CO2 conversion was basically unchanged with the increase of contact time,which indicated that carbon in CH3OH was generally from CO,while CO2 concentration was in equilibrium formed by water-gas shift reaction and CO2 hydrogenation to methanol.
我国煤炭资源丰富, 随着社会对生态环境的日益重视, 煤炭的清洁利用受到越来越多关注。作为一条洁净煤炭利用途径, 煤炭气化及其下游的合成气合成工业吸引了众多学者探索研究。甲醇是一种重要的化工原料、清洁的液体燃料和有潜力的氢气载体。以煤炭气化获得的合成气生产甲醇, 再经甲醇转化为其他依赖石油化工的产品是一条有前景的煤代替油技术路线。工业上用合成气生产甲醇一般采用Cu/ZnO/Al2O3催化剂, 在(5~10) MPa和(230~280) ℃条件下进行。目前, 国内市场上大型甲醇生产装置一般采用国外催化剂, 如Kataclo51-9催化剂和MK121催化剂[1]。自20世纪90年代以来, 国内学者对铜基甲醇合成催化剂进行了多方面研究[2, 3, 4, 5, 6, 7, 8, 9, 10], 推动了国产甲醇合成催化剂的工业应用。
催化剂的工艺参数优化是催化剂开发到实际工业应用的必要基础数据, 可靠的工艺参数数据有助于催化剂性能的改进及反应操作条件的优化。甲醇合成的反应机理, 如甲醇的直接碳源和加氢过程中的中间产物, 现在仍然有争议[11, 12, 13]。本工作在接近工业原料组成的合成气条件下, 对一种自主研制的合成甲醇催化剂进行工艺参数优化的实验, 考察反应温度和接触时间对合成甲醇反应速率的影响, 同时根据反应过程中各组分的变化情况对合成甲醇的反应机理进行探讨。
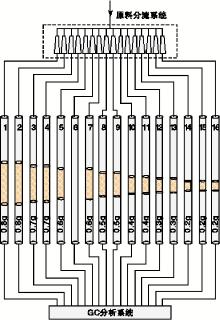
实验采用德国HTE公司16通道微型多管组合式反应装置, 如图1所示。
该装置通过毛细管分流系统, 将一路原料气体均匀分流成16路, 分配到16根管式反应器中, 各反应管内原料气体流速相同, 组分具有很好的一致性。实验压力为4 MPa, 反应温度为(190~260) ℃, 在催化剂装填量为0.8 g时的空速为8 000 h-1。实验在230 ℃通过逐步增加流速、同时增加催化剂装填量保持空速不变的方式消除外扩散作用的影响, 确定合适的流速。设计的原料气组成为:x(CO)=13%, x(CO2)=1.2%, x(H2)=80%, x(Ar)=5.8%, 气体由北京氦普北分气体工业有限公司提供。
通过改变催化剂装填量调节空速, 催化剂装填情况如图1所示。为保证数据准确性, 催化剂装填量为0.3 g、0.4 g、0.5 g、0.6 g、0.7 g和0.8 g的实验分别使用两根反应管, 催化剂装填量为0.2 g的实验使用3根反应管, 其中, 6#反应管未添加催化剂, 而是填充同粒度石英砂, 用于在线检测原料气体组成。催化剂粒径为(60~100)目, 装填时采用同粒度石英砂与催化剂相互掺混。在230 ℃通过逐步增加催化剂目数的方式考察内扩散作用的影响, 确定合适的催化剂粒径。
催化剂还原后, 通入的原料气在催化剂作用下发生反应, 反应后气体包括甲醇进入到气相色谱仪分析气体组成。通过加热带加热稳定气体产物温度在120 ℃。实验选择8个停留温度点190 ℃、200 ℃、210 ℃、220 ℃、230 ℃、240 ℃、250 ℃和260 ℃, 在每个温度点, GC分析系统轮流对每一个反应管出口处的气体样品取样并进行检测, 每根反应管轮流重复取样检测6次。
实验数据处理包括实时原料气体组成的确定、CO、H2和CO2转化率的计算、甲醇产率计算以及CO和CO2转化速率计算。
(1) 实时原料气体组成。通过对6#反应管出口处气体样品检测分析, 并对多次取样结果求平均值, 获得实时原料气体组成为:x(H2)=79.82%, x(CO)=12.68%, x(CO2)=1.29%, x(Ar)= 6.21%。
(2) CO、H2和CO2转化率计算。以Ar为标准气体计算CO、H2和CO2转化率:
式中, xi为CO、H2或CO2的转化率; yi, 0为原料气体中CO、H2、CO2或Ar物质的量分数; yi为出口气体产物中CO、H2、CO2或Ar物质的量分数。
(3) 甲醇相对含量计算。以Ar为标准气体, 对出口气体产物中甲醇相对物质的量分数进行计算:
xm=
式中, xm为甲醇相对物质的量分数; ym为出口气体产物中甲醇物质的量分数。
在x(H2)=79.82%、x(CO)=12.68%、x(CO2)=1.29%、x(Ar)= 6.21%和压力4 MPa条件下, 考察反应温度和接触时间对合成甲醇反应的影响, 结果见图2。
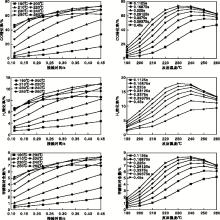 | 图2 CO转化率、H2转化率以及甲醇相对含量随接触时间和温度变化曲线Figure 2 Effects of contact time and reaction temperature on CO, H2conversion, and relative content of CH3OH |
从图2可以看出, CO转化率为0~74%, 反应温度较低时, 随着接触时间的延长, CO转化率增加。反应温度增至240 ℃时, CO转化率的增加开始变得缓慢。进一步升高反应温度, CO转化率随着接触时间延长开始保持不变甚至略有下降。从250 ℃和260 ℃下的CO转化率趋向于稳定的现象可以推断, 随着接触时间的延长, 两个反应温度下的气体组成逐渐达到热力学平衡, 这也是在较长接触时间下250 ℃的CO转化率略高于260 ℃的原因。260 ℃时的CO转化率随接触时间延长略降的可能原因是部分甲醇在催化剂作用下发生分解[14]。
H2转化率为0~18%。H2转化率随接触时间和反应温度的变化规律与CO转化率有很好的一致性。随着反应温度升高, 在短接触时间条件下, CO转化率逐步增加, 而在长接触时间条件下, 开始出现先升高后降低的趋势, 并且各接触时间下出现的CO转化率峰值随接触时间延长向低温偏移。本实验条件下, 最高CO转化率出现在接触时间0.45 s和反应温度(230~240) ℃。合成气制甲醇是放热反应, 受热力学平衡的影响, CO平衡转化率随着反应温度的升高而下降。CO转化率随反应温度增加先升高后降低的现象同样也是热力学限制所致。可以看出, 接触时间越长, 达到热力学平衡时的温度点越低。
尾气中甲醇相对含量为0~8%。甲醇生成与CO转化具有非常好的对应关系, 这也体观了本实验条件下CO向甲醇转化反应的良好选择性。
在x(H2)=79.82%、x(CO)=12.68%、x(CO2)=1.29%、x(Ar)= 6.21%和压力4 MPa条件下, 考察CO2转化率随接触时间和反应温度的变化规律, 结果见图3。
从图3可以看出, CO2转化率为5%~17%。较低反应温度下, CO2转化率随着接触时间的延长基本保持稳定或在一个很小的范围内(± 1%)波动, 从这一现象可以推断, 此条件下CO2的消耗(式2)和生成(式3)处于一个动态平衡的状态。合成气合成甲醇主要发生的化学反应有:
CO+2H2⇌CH3OH (1)
CO2+3H2⇌CH3OH+H2O (2)
CO+H2O⇌CO2+H2 (3)
一般认为, 在铜基催化剂条件下水汽变换反应(式3)快于CO2加氢反应(式2), 即式2是这一转化过程的速率控制步骤, 水汽变换反应处于平衡状态。CO2加氢反应生成的水参与水汽变换反应, 被迅速消耗转化为CO2, 通过这样一个循环使体系中CO2浓度可以维持基本不变。260 ℃条件下, CO2转化率随着接触时间延长出现较明显下降。原因可能是260 ℃的反应温度使反应体系容易达到平衡, 再延长接触时间, 甲醇与水蒸汽反应(式2逆反应)分解生成CO2。
随着反应温度的增加, CO2转化率呈现较为明显下降的趋势。反应温度升高有利于CO2加氢反应速率的提高, 促进CO向甲醇的转化。在相同接触时间下, 反应温度越高, CO浓度越低, 而甲醇浓度越高, 反应体系越趋近于平衡, 有利于促进甲醇与水蒸汽的反应(式2逆反应); 同时甲醇分解反应是吸热反应, 反应温度升高有利于反应的进行。这可能是体系中CO2转化率随反应温度升高而降低的原因。本实验条件下, CO是形成甲醇的主要碳源, CO2起到的是一种类似中间媒介的作用, 为CO提供一条加氢形成甲醇的反应路径。
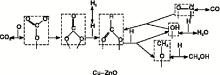
图4显示了甲酸盐机理解释水汽变换反应与CO2加氢合成甲醇反应的路径。CO2经过吸附加氢转化, 形成甲酸根中间物种HCOO-, HCOO-向甲氧根(CH3O-)的转化被认为是反应的速控步骤[14], 这一转化形成的表面氢氧根(-OH)是CO发生水汽变换的重要物种。当反应体系中CO浓度未达到平衡时, CO2转化形成反应的中间媒介-OH, 促进CO的转化。CO浓度逐渐接近平衡时, 甲醇渐渐开始与体系中的水蒸汽反应[15], 使体系中的CO2浓度回归到接近于初始水平。
采用自主研制的合成甲醇催化剂, 考察反应温度(190~260)℃和接触时间(0.112 5~0.45) s对合成甲醇反应的影响。在接触时间0.45 s和反应温度(230~240) ℃下, 最高CO转化率约74%。CO是合成甲醇的主要碳源, CO先经过水汽变换反应转化为CO2, 再加氢转化为甲醇是主要的反应路径。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|