作者简介:李海涛,1982年生,男,硕士研究生导师。E-mail:htli@sxu.edu.cn
在液相还原法制备的纯Cu2O样品中,采用浸渍法分别引入Mg、Al、Fe助剂制备Cu2O-MgO、Cu2O-Al2O3、Cu2O-Fe2O3催化剂。采用XRD、FT-IR、TEM和H2-TPR等对催化剂进行表征,研究不同助剂的加入对甲醛乙炔化反应的影响。结果表明,不同助剂对催化剂的结晶度和可还原性能有较大影响,进而使甲醛乙炔化表现出不同的催化活性。相比MgO与Al2O3,Fe2O3的引入,使Cu2O结晶度明显下降,主要是由于Fe2O3与Cu2O之间产生强的相互作用,有利于乙炔亚铜活性物种的形成,从而表现出最优的催化性能。
Mg,Al and Fe additives were introduced to pure Cu2O samples prepared by liquid phase reduction to prepare Cu2O-MgO,Cu2O-Al2O3 and Cu2O-Fe2O3 catalyst. XRD,FT-IR,TEM and H2-TPR were used to characterize the effects of additives on acetylation of formaldehyde.The results showed that additives had great influence on the crystallinity and reducibility of the catalyst,and led to different catalytic performance for formaldehyde acetylation.Compared with MgO and Al2O3,the introduction of Fe2O3 significantly decreased the crystallinity of Cu2O due to the strong interaction between Fe2O3and Cu2O,which was conducive to the formation of active species of cuprous alkyne,and finally resulted in optimal catalytic performance.
1, 4-丁炔二醇是一种兼有— C≡ C— 和— OH的炔醇化合物, 化学性质活泼, 可向下游延伸制备一系列高附加值化学品及聚酯新材料, 在电镀、人造革、医药、农药等领域广泛应用[1, 2, 3, 4, 5]。1, 4-丁炔二醇的工业生产采用Reppe法[6, 7], 即以甲醛和乙炔为原料, CuBi氧化物或碳酸盐为催化剂, 亲核加成反应得到1, 4-丁炔二醇。围绕高性能Cu基催化剂的开发, 早期专利[8]报道了CuO-Bi2O3催化剂以及孔雀石催化剂。近年来, 本课题组研究了新型CuO-Bi2O3/SiO2-MgO气凝胶催化剂[9]、CuO-Fe3O4磁性分离催化剂[10]、核壳结构的CuO@SiO2催化剂[11]、层状页硅酸铜催化剂[12]以及CuO-ZnO复合物催化剂[13]等, 其在甲醛乙炔反应中均表现出较好的使用性能。
上述催化剂在甲醛乙炔化反应中通过原位转化得到Cu+炔化物, Cu+炔化物作为活性物种表现出高的炔化性能。由于Cu2+转变为Cu+过程的不可控性, Cu2+可能会过渡还原为Cu0, 造成副产物聚乙炔的增加[10, 11], 直接以Cu2O为催化剂前驱体替代CuO将省去Cu2+还原为Cu+的过程。本课题组首次以Cu2O取代了CuO应用于甲醛乙炔化反应中, 直接将Cu2O转变为乙炔亚铜, 使得催化剂的活化时间大大缩短, 催化活性大幅提高[14]。进一步以TiO2为载体, 通过载体晶相组成调控以及N掺杂等方式有效调控了Cu2O的晶粒尺寸和可还原性, 并借助TiO2表面氧空穴及TiO2与Cu2O间异质结构, 提高了炔化反应性能[15, 16, 17, 18]。Cu2O催化剂表现出优异的初始活性, 但在长时间运行时, 仍存在Cu+过度还原为金属Cu导致的催化剂失活。
本文在前期Cu2O催化剂研究基础上, 进一步通过掺杂助剂的方式提高催化剂的使用性能, 探讨Mg、Al、Fe助剂对Cu2O催化剂结构及甲醛乙炔化反应性能的影响, 为开发高效的甲醛乙炔化催化剂提供参考。
Cu2O制备:移取100 mL的Cu(NO3)2· 3H2O溶液(0.125 mol· L-1)至1 000 mL烧瓶中, 将烧瓶置于30 ℃恒温水浴中。磁力搅拌下, 将100 mL的PEG-600加至上述溶液中。量取150 mL的NaOH溶液(1.67 mol· L-1)和300 mL的L-抗坏血酸钠溶液(0.25 mol· L-1)混合后滴加入其中, 滴加速率1.25 mL· min-1。滴加完毕后继续搅30 min, 恒温静置1 h。产物经离心分离后用蒸馏水和无水乙醇分别洗涤3次, 60 ℃真空干燥4 h, 得到的样品标记为Cu2O。
Cu2O-MxOy催化剂(M = Mg、Al、Fe) 制备:分别移取10 mL金属M的硝酸盐溶液(3 mol· L-1)至圆底烧瓶中, 加入2 g的Cu2O, 超声20 min, 磁力搅拌30 min, 离心后, 将所得固体产物于60 ℃真空干燥4 h, 在N2气氛300 ℃焙烧3 h, 得到的样品标记为Cu2O-MgO、Cu2O-Al2O3和Cu2O-Fe2O3。
XRD在德国布鲁克公司D8 Advancex射线粉末衍射仪上进行, CuKα , λ =0.154 2 nm, 工作电压40 kV, 工作电流40 mA, 扫描范围10° ~80° , 扫描速率5° · min-1。
透射电镜在日本JEOL公司JEM-2100电子显微镜上进行测试。
FT-IR分析在德国布鲁克公司Tensor 27型红外光谱仪上进行, 向被测样品中掺入一定比例的KBr压片, 扫描波数范围(400~4 000) cm-1, 分辨率4 cm-1。
在美国麦克仪器公司AutoChemⅡ 2920型全自动程序升温化学吸附仪上进行化学吸附, 吸附气体为5%H2-95%N2, 气体流速20 mL· min-1, 升温速率10 ℃· min-1, TCD检测器。
向装有冷凝管的100 mL圆底三口烧瓶中依次加入2.5 g催化剂与50 mL甲醛(39%)水溶液, 先通N2排空气, 与此同时, 将反应体系进行搅拌, 并加热至90 ℃, 停止通N2, 改通乙炔气, 在90 ℃条件下反应10 h。待反应后的物料降至室温后停止通气, 离心分离出上清液, 采用Agilent7890A型气相色谱仪对产物定量分析, 并使用碘量法测量反应液中未转化的甲醛。
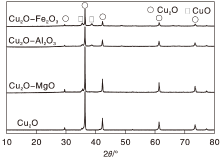
图1为不同助剂修饰Cu2O催化剂样品的XRD图。由图1可知, 各催化剂均约在29.6° 、36.5° 、42.4° 、61.4° 、73.6° 及77.4° 出现立方相Cu2O的(110)、(111)、(200)、(220)、(311)及(222)晶面特征衍射峰(JCPDS卡片, 编号05-0667)。与Cu2O衍射峰相比, 在Cu2O中掺入MgO后, Cu2O晶面衍射峰未发生明显变化, 仍保持尖锐的晶相衍射峰, 而在Cu2O中掺入Al2O3、Fe2O3后, 衍射峰强度明显减小, 分散度大幅提高, 同时, 在约35.5° 、38.7° 出现CuO特征衍射峰, 表明部分Cu2O发生氧化, 转变为CuO物种。
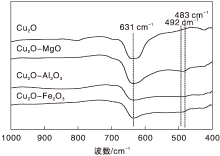
采用FT-IR对不同助剂修饰Cu2O催化剂作进一步表征, 结果见图2。由图2可以看出, 各催化剂均在631 cm-1处出现Cu2O的特征吸收峰, 归属于Cu-O键的伸缩振动[19]。Cu2O-MgO样品在483 cm-1处出现Mg-O键的振动峰[20], 表明MgO成功引入到Cu2O表面。Cu2O-Al2O3和Cu2O-Fe2O3样品均在约500 cm-1处出现CuO的Cu-O键的振动吸收峰[21], 与XRD表征结果相似, 进一步证明在Cu2O-Al2O3和Cu2O-Fe2O3样品中存在少量CuO。
图3为不同助剂修饰Cu2O催化剂的TEM照片。由图3可知, 纯Cu2O样品为立方体形貌, 结晶趋于完整。引入MgO后制备的Cu2O-MgO样品中Cu2O颗粒形貌未发生明显变化, 仅在颗粒外表面附着了不规则排布的微小颗粒, 推测为无定形的MgO颗粒。引入Al2O3及Fe2O3后, Cu2O颗粒变得不规整, Cu2O清晰的边、棱、角消失, 外层附着了无定形结构的大颗粒, 推测Cu2O在溶液中发生二次反应, 晶体结构被破坏。结合XRD表征, 在Al及Fe的溶液中Cu2O氧化为CuO, 结晶度下降。
对不同助剂修饰Cu2O催化剂进行H2-TPR表征, 结果示于图4。由于MgO、Al2O3、Fe2O3较难在低温下被H2还原, 图4中所有样品的还原耗氢峰均归属于Cu+或Cu2+到金属Cu的还原。由图4可知, 纯Cu2O样品的还原峰温度为(250325) ℃, 峰顶温度290 ℃, 结合XRD表征, 该峰归属为结晶性较为完整的体相Cu2O的还原耗氢峰。在Cu2O中分别引入MgO、Al2O3及Fe2O3后, 3种样品的还原峰存在明显差异。Cu2O-MgO样品的还原峰温度与纯Cu2O相似, 为(250325) ℃, 峰顶温度为275 ℃, 起始温度较纯Cu2O略向低温区移动, 主要与催化剂表面存在部分CuO相关。Cu2O-Al2O3样品的还原峰向低温区迁移, 在(210310) ℃出现峰顶温度为270 ℃主还原峰和225 ℃的还原肩峰, 前者归属于高分散的Cu2O与Al2O3存在弱的相互作用的铜物种的还原, 后者归属于孤立的CuO颗粒的还原。Cu2O-Fe2O3样品的还原峰温度则较纯Cu2O向高温区迁移, 还原峰温度(250350) ℃, 主耗氢峰温度为325 ℃, 归属于与Fe2O3存在强相互作用的铜物种的还原, 因其表面存在大量CuO, 起始温度相对较低。
在甲醛乙炔化反应中, 乙炔是过量的, 以甲醛的转化计算转化率与产物选择性。不同助剂修饰Cu2O催化剂的活性评价结果如表1所示。
| 表1 不同助剂修饰Cu2O催化剂的活性评价结果 Table 1 Catalytic performance of Cu2O catalysts with different promoters |
由表1可以看出, 在Cu2O中引入助剂后, 甲醛转化率均有不同程度提高, 其中, Cu2O-Fe2O3催化剂表现为最高的甲醛转化率78.9%。与纯Cu2O相比, Cu2O-MgO催化剂上1, 4-丁炔二醇选择性有所下降, 考虑到产物中未观察到丙炔醇副产物, 推测部分甲醛转变为聚甲醛沉积到催化剂表面。在Cu2O-Al2O3及Cu2O-Fe2O3催化剂上1, 4-丁炔二醇选择性有所升高, 表明聚甲醛副产物减少。另一方面, 甲醛作为还原剂, 将Cu2+还原为Cu+也是造成1, 4-丁炔二醇选择性不到100%的原因。对比4种催化剂的1, 4-丁炔二醇收率, Cu2O-Fe2O3最高, Cu2O-Al2O3与Cu2O-MgO次之, Cu2O最差。
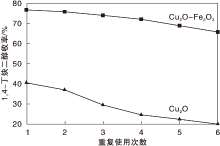
为考察催化剂稳定性, 对1, 4-丁炔二醇收率最好的Cu2O-Fe2O3催化剂和1, 4-丁炔二醇收率最差的Cu2O催化剂进行6次重复使用实验, 结果如图5所示。
由图5可以看出, 随着重复使用次数增加, 两种催化剂上的1, 4-丁炔二醇收率下降, 其中, Cu2O催化剂上1, 4-丁炔二醇收率下降较为明显, 经6次重复使用后由40.7%下降至19.5%, 而Cu2O-Fe2O3催化剂上1, 4-丁炔二醇收率均高于65%。
结合对催化剂的表征结果推测, Cu2O-Fe2O3催化剂高的乙炔化活性源于Cu2O与Fe2O3之间强的相互作用。一方面, 强相互作用抑制了活性物种的迁移聚集, 分散度大幅提高, 有利于暴露更多的活性位点; 另一方面, 强相互作用可有效抑制Cu+被过度还原为Cu0, 使其能高效转变为乙炔亚铜活性物种, 而Cu2O-Al2O3与Cu2O-MgO也表现为较Cu2O高的1, 4-丁炔二醇收率, 可能归因于助剂对Cu物种的分散作用。
(1) 在Cu2O催化剂中掺入不同的金属助剂, 对催化甲醛乙炔化反应性能有较大影响。
(2) 在Cu2O催化剂中引入MgO, 不影响Cu2O结晶度, 同时由于MgO与Cu2O的相互作用较弱, 该催化剂的乙炔化活性较Cu2O无明显提升。
(3) 在Cu2O催化剂中引入Al2O3, Cu2O结晶度显著降低, 起到了分散Cu2O物种的作用, 但因Al2O3与Cu2O的相互作用较弱, 该催化剂的乙炔化活性较Cu2O仅有小幅提升。
(4) 在Cu2O催化剂中引入Fe2O3, 不仅提高了活性组分的分散度, 而且Cu+的稳定性显著提高, 使其能够高效转化为乙炔亚铜活性物种, 表现出最优的催化性能。Cu2O-Fe2O3催化剂也表现出最佳的稳定性, 重复使用6次, 1, 4-丁炔二醇收率高于65%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|