作者简介:常峥峰,1988年生,男,安徽省淮北市人,博士,从事大气污染治理、脱硝催化剂开发及研究。
UV/TiO2光催化技术在TiO2催化剂的作用下可将烟气中Hg0氧化脱除。利用自制的UV/TiO2氧化试验台研究了影响Hg0去除率的相关因素,结果表明,在无催化剂和有紫外灯情况下可脱除少量Hg0;Hg0去除率随催化剂活性组分含量的增加而上升,但上升速率逐渐下降;在温度(50~200) ℃范围内,Hg0去除率无明显变化;Hg0去除率随着Hg0初始浓度的升高逐渐下降;Hg0去除率随着烟气中氧含量先上升后趋于不变。UV/TiO2氧化工艺脱汞可为燃煤电厂烟气脱汞提供理论指导。
UV/TiO2 photocatalytic technology can oxidize Hg0 in flue gas by TiO2 catalyst.In this paper,the related factors of Hg0 removal rate were studied by self-made UV/TiO2 oxidation test bench.The results show that a small amount of Hg0 can be removed without catalyst and UV lamp.The removal efficiency increases with the increase of catalyst active component content.However,the rate of ascending decreases gradually.In the experimental temperature range of (50-200) ℃,the removal efficiency does not change significantly.While the removal efficiency decreases with the increase of the initial concentration of Hg0.The removal efficiency tends to increase to a constant with the increase of oxygen content in the flue gas.Therefore,the oxidation process can provide theoretical guidance for mercury removal from coal-fired power plants.
光催化技术是一种新兴、高效、节能的现代绿色环保技术, 光催化技术是在催化剂的作用下, 利用光辐射将污染物分解为无毒或毒性较低物质的过程[1]。在众多的光催化剂中, TiO2以其催化性能良好、化学性能稳定、安全无毒、无副作用、使用寿命长、价廉等优点而被广泛使用[2, 3, 4]。自1972年Fujishima A和Honda K发现受光照射的TiO2微粒上可使水持续地发生氧化还原反应[5], 到美国和西班牙研究者开发的悬浮TiO2水处理系统; 从对微弱光下环境自净材料的研究和TiO2双亲特性的发现, 到日本学者通过N掺杂制备的激发波长在可见光范围内的催化剂, 半导体光催化技术以其强氧化性和能利用太阳光等特点吸引着众多学者, 该技术具有结构简单、操作条件容易控制、氧化能力强、无二次污染等优点。当前, 具有潜在应用价值的光催化技术是环境保护、化学合成和新材料等领域的研究热点[6]。本文利用自制的UV/TiO2氧化试验平台研究影响Hg0去除率相关因素。
根据固体能带理论, 固体是一大分子, 由许多原子或分子在空间以一定的方式排列而成。当组成固体的原子或分子相互接近时, 能量相近的原子或分子轨道发生相互重叠, 产生属于整个固体的一组新轨道[7]。这些轨道能级彼此非常接近, 可以看成是连续的能带。正常情况下, 体系中的电子总是占据能量较低的能级, 充满电子的最高能带叫价带, 未充满电子的最低能带叫导带。价带中最高能级与导带中的最低能级之间的能量差叫禁带宽度(简写为Eg)[8, 9, 10]。当半导体在波长小于或等于其禁带激发波长Eg的光照射时, 半导体价带上的电子(e-)被激发跃迁至导带, 从而在价带上留下空穴(h+)。半导体受激发产生的电子-空穴对(e-/ h+)可以在体相或表面复合放出热能, 也可以与半导体表面的物质发生氧化还原反应[11]。
锐钛矿相TiO2禁带宽度Eg=3.2 eV, 要将价带上的电子激发到导带上需要较高的能量, 光的波长需小于387.6 nm[12], 即只有波长λ < 387.6 nm的光照射TiO2半导体才能有效果, 所以TiO2的光催化作用一般在紫外光(UV)的照射下才能产生。
当紫外灯照射TiO2时, 电子吸收紫外线能量突破价带和导带之间的能级而逸出, 形成电子-空穴对, TiO2表面的空穴有极强的捕电子能力, 可夺取H2O分子中的电子从而产生氧化性极强的· OH自由基, TiO2表面的电子与水及烟气中的氧反应也会生成· OH及
(1)紫外灯照射TiO2产生电子-空穴对:
TiO2+hv→ TiO2(e- + h+)
(2)光生空穴参与反应, 产生氧化性自由基:
H2O + h+→ · OH + H+
OH- + h+→ · OH
(3)光生电子参与反应, 产生氧化性自由基:
O2+ e-→
2HO2→ O2+ H2O2
HO2+H2O+e-→ H2O2+OH-
H2O2+e-→ .OH+ OH-
(4)氧化性自由基氧化Hg0。
石英砂颗粒[粒径为(4~6) mm], 纳米级TiO2粉体, 去离子水, NaOH溶液。
JM 2003型电子天平, 余姚纪铭校验设备有限公司; DF— Ⅱ 磁力加热搅拌器, 金坛市荣华仪器制造有限公司; HN202— T台式干燥箱, 南通沪南科学仪器有限公司; 烧杯、玻璃棒, 南京中东化玻仪器有限公司。
将石英砂颗粒洗净后用浓度为1 mol· L-1的NaOH溶液浸泡2 h, 取出后用去离子水反复冲洗干净, 晒干, 取一定量备用。
称取一定量的纳米级TiO2粉体, 加入去离子水, 磁力搅拌4 h, 超声波震荡分散2 h, 形成一定浓度的稳定悬浊液。将称好的石英砂加至TiO2悬浊液中, 超声波震荡1 h, 使TiO2充分负载到石英砂上, 最后将整个物系转移到烘箱中160 ℃烘干, 制得含有一定活性组分的光催化剂[16]。
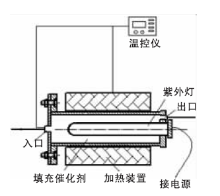
光催化氧化小试实验在自制的试验台上进行, 整个实验台由烟气模拟部分、光催化氧化反应部分、尾气分析部分组成, 其中烟气模拟部分和尾气分析部分与UV/H2O2高级氧化工艺实验装置大致相同(其中烟气模拟部分增设一台水蒸气发生器及其管路), 光催化氧化反应部分如图1所示。
采用不锈钢管式反应器, 不锈钢管内径47 mm、长600 mm, 紫外灯管直径20 mm、长330 mm, 功率25 W, 在紫外灯管与不锈钢管内壁之间填充自制的光催化剂。模拟烟气自左向右经过光催化剂层。
反应器采用外部电加热, 为减少散热量, 在电热元件外包有保温棉。反应温度由插入管内的热电偶测量, 并由温度控制仪控制。热电偶的信号传至温控仪, 当温度接近设定值时, 加热电流逐渐减小, 直至逼近设定值。
每次试验可记录15个数据, 将15个数据取平均值作为尾气中单质汞的最终浓度, 烟气中的Hg0去除率由下式算得:
η =
式中, η 为Hg0去除率, %; Cin为烟气中Hg0的初始浓度, μ g· m-3; Cout为尾气中Hg0的浓度, μ g· m-3。
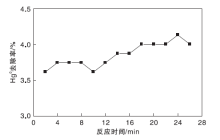
在无催化剂、有紫外灯情况下设定反应温度为150 ℃, 预热30 min后配气通入试验台, 气体总流量为2 120 mL· min-1, O2气瓶流量为100 mL· min-1, 载汞高纯N2的流量稳定在150 mL· min-1, 汞渗透管恒温水浴维持在50 ℃, 平衡气为N2。待模拟烟气中Hg0浓度稳定后开始计时测量, 结果如图2所示。
从图2可以看出, 仅用紫外灯照射也能使少部分Hg0转化, 可能的原因是混合气中的少量O2、H2O等分子受紫外线照射时, 产生了少量的具有氧化性的自由基或者生成了少量氧化物(如O3), 这些物质氧化了Hg0; 另外, 烟气中的O2对Hg0的转化效率也有一定的贡献[17]。
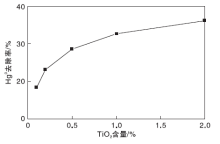
以石英砂为载体, 制备活性组分TiO2含量分别为0.1%、0.2%、0.5%、1%和2%的光催化剂各100 g。每次将一份光催化剂填装进试验台, 设定温度为150 ℃, 预热30 min后配气通入试验台, 气体总流量为2 120 mL· min-1, O2气瓶流量为100 mL· min-1, 载汞高纯N2的流量稳定在150 mL· min-1, 汞渗透管恒温水浴维持在50 ℃, 平衡气为N2。活性组分含量对Hg0去除率的影响如图3所示。
从图3可以看出, 光催化剂的脱汞效率随着活性组分含量的增加而上升, 但上升速率逐渐下降。可能的原因是TiO2含量越多, 在紫外灯照射下产生的氧化性自由基也越多, 对Hg0的氧化效果越好; 但TiO2含量达到一定程度时, 过多的TiO2负载在载体表面会阻碍紫外线的透过, 即一部分TiO2被前面的TiO2挡住, 因此脱汞效率的上升速率逐渐下降[18]。
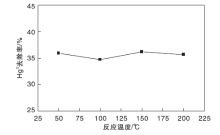
将活性组分含量为2%的光催化剂填装进试验台, 设定相应温度, 预热30 min后打开紫外灯, 配气通入试验台, 气体总流量为2 120 mL· min-1, O2气瓶流量为100 mL· min-1, 载汞高纯N2流量稳定在150 mL· min-1, 汞渗透管恒温水浴维持在50 ℃, 平衡气为N2。考察温度对Hg0去除率的影响, 结果如图4所示。从图4可以看出, 温度在(50~200)℃范围内, 光催化脱汞效率无明显变化。
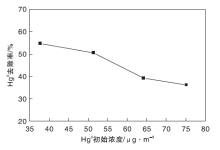
将活性组分含量为2%的光催化剂填装进试验台, 设定温度为125 ℃, 预热30 min后配气通入试验台, 气体总流量为2 120 mL· min-1, O2气瓶流量为100 mL· min-1, 载汞高纯N2的流量稳定在150 mL· min-1, 精确控制汞渗透管恒温水浴维持在不同温度以满足实验要求, 平衡气为N2。考察Hg0初始浓度对光催化脱汞效率的影响, 结果如图5所示。
从图5可以看出, 光催化脱汞效率随着Hg0初始浓度的升高而下降。可能的原因是在系统稳定时, 光催化剂表面的最大活性位数量是一定的, 当Hg0初始浓度增加时, 光催化反应速率变化不明显, 故而光催化脱硝效率随着Hg0初始浓度的升高而下降[19, 20]。
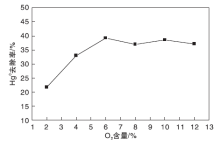
将活性组分含量为2%的光催化剂填装进试验台, 设定温度为125 ℃, 预热30 min后配气通入试验台, 气体总流量为2120 mL· min-1, 精确控制O2气瓶流量为使其满足实验要求, 载汞高纯N2的流量稳定在150 mL· min-1, 汞渗透管恒温水浴维持在50 ℃, 考察烟气含氧量对光催化脱汞效率的影响, 结果如图6所示。
从图6可以看出, 光催化脱汞效率先随着含氧量的升高而上升, 当含氧量为6%时, 光催化剂的脱汞效率达到最大, 为39.2%; 当含氧量大于8%时, 光催化剂的脱汞效率基本不变。可能的原因是在系统稳定时, 光催化剂的表面最大活性位数量是一定的。当氧含量小于6%时, 光催化剂表面的活性位未被完全利用, 含氧量越高, 活性位被利用的数量越多, 产生的氧化性自由基越多, 因此光催化脱汞效率随着含氧量的升高而上升; 当含氧量大于6%时, 光催化剂表面的活性位被完全利用, 产生的氧化性自由基数量几乎不变, 因此光催化剂的脱汞效率基本不变[21]。
(1) UV/TiO2光催化氧化工艺可以有效去除烟气中的部分Hg0, 仅有紫外灯照射时, 也能使少量Hg0转化。
(2) UV/TiO2光催化剂上Hg0去除率随着催化剂活性组分含量的增加而上升, 但上升速率逐渐下降; 在温度(50~200) ℃范围内, Hg0去除率无明显变化; Hg0去除率随着Hg0初始浓度的升高逐渐下降; Hg0去除率随着烟气中氧含量先上升后趋于不变, 含氧量为6%时, 光催化剂的脱汞效率达到最大, 为39.2%。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|