作者简介:吕宇皓,1989年生,男,博士,工程师,主要研究方向为工业催化。
活性氧化铝性质活泼,在有水环境中会发生水合现象,使其织构性质变化,造成催化剂强度下降,导致催化剂不可逆失活。氧化铝水合过程有两种方式:氧化铝表面Al-O键水解和表面氧化铝溶解后再以水合氧化铝的形式析出。在氧化铝表面形成尖晶石结构仅可以延缓氧化铝水合;采用Si和P改性,在Al2O3表面形成稳定的Si-O-Al和P-O-Al结构,消除氧化铝表面羟基,可以有效提高Al2O3水热稳定性。
Transition aluminas hydration occurs when they are applied in water-containing process.Alum-inas stability in aqueous phase is a key issue for catalytic processes,as their hydration is strongly detrimental to their physico-chemical and mechanical properties.There are two mechanisms that may well occur in parallel during aluminas hydration: surface hydration through hydrolysis of Al-O bonds or dissolution of γ-Al2O3 and subsequent precipitation of hydrated aluminas.Besides the formation of spinel structure on aluminas surface can retards their hydration,Si/P modified aluminas can also enhance their hydrothermal-stability by eliminating the surface OH groups and forming more stable Si-O-Al/P-O-Al structure on aluminas surface.
活性氧化铝具有织构性质灵活, 热稳定性好, 价格低廉等优点, 是石油和化工工业中应用最广泛的一种催化剂和催化剂载体。迄今为止, 已发现8种具有不同结构与性质的氧化铝形态[1, 2, 3, 4], 其物化性质取决于不同前驱体拟薄水铝石及其制备方法。氧化铝性质活泼, 在有水环境中, 极易水合形成氧化铝水合物, 使其织构性质变化, 并引起机械性能下降, 造成催化剂不可逆失活[5, 6, 7, 8, 9, 10, 11, 12], 因此, 氧化铝抗水合性能亟待提高。本文对氧化铝同质多晶体及其表面性质, 氧化铝水合和抗水合研究进行简要综述。
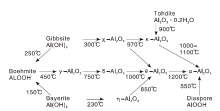
水合氧化铝受热分解即可得到活性氧化铝, 目前已知水合氧化铝有7种类型[1, 13], 如表1所示, 其中, 有4种三水铝石[Al(OH)3]:拜耳石(Bayerite)、三水铝石(Gibbsite)、诺三水铝石(Nordstrandite)和督三水铝石(Doyleite), 2种一水铝石(AlOOH):勃姆石(Boehmite)和硬水铝石(Diaspore)以及1种六方水铝石(Tohdite)。水合氧化铝制备过程如图1所示, 原料铝土矿(Bauxite)是铝铁氢氧化物的混合物, 需先经过拜尔工艺(Bayer process)纯化水化, 再采用电解法、强碱侵蚀方法或酸侵蚀方法得到中间体, 最后将其水解或沉积沉淀制得水合氧化铝[14]。由于提炼或制备方法的差异, 水合氧化铝中含有数量不等的碱金属氧化物、铁氧化物和硫酸盐杂质。
氧化铝具有多种同质多晶体, 目前已发现有8种铝氧化物存在[1, 2, 13]。水合氧化铝受热分解一般先生成无定形氧化铝(ρ -Al2O3或a-Al2O3), 其后形成相应晶型氧化铝[13]。水合氧化铝热分解过程和氧化铝同质多晶体相变过程如图2所示。
α -Al2O3是众多氧化铝晶型中热力学最稳定的一种结构, 氧化铝同质多晶体受热最终都会转晶至α -Al2O3。由图2可知, 勃姆石热解生成的γ -Al2O3和拜耳石热解得到的η -Al2O3晶体结构相近, 随着温度升高, η -Al2O3会直接转晶至θ -Al2O3, 而γ -Al2O3则会先转晶至δ -Al2O3再转晶至θ -Al2O3。三水铝石在300 ℃受热分解先生成大比表面积的χ -Al2O3 (400 m2· g-1), 随着受热温度升高, 在970 ℃转晶至κ -Al2O3, 在1 100 ℃转晶至α -Al2O3。
氧化铝中除因原料和制备方法所致含有少量碱金属氧化物、铁氧化物和硫酸盐杂质外, 氧化铝表面还因环境因素(温度和水蒸汽压)含有5%左右的水, 它们分别通过物理吸附, 化学吸附或解离后在氧化铝表面形成羟基形式存在[5, 15], 如图3所示。室温下, 氧化铝通过氢键作用将水分子吸附在表面, Peri J B[16]研究γ -Al2O3水合作用时发现, 每1 nm2水合γ -Al2O3表面上存在13个水分子, 高温处理时, 水分子一部分脱附, 另一部分与氧化铝反应生成羟基, 随着温度继续升高, 羟基通过两两缩合脱水逐渐排出体系, 但即使在8 00~1 000 ℃的真空中, 氧化铝表面仍会含有一定数量的羟基[17]。
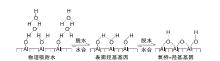 | 图3 氧化铝表面物理吸附水、化学吸附水和氧桥羟基Figure 3 Physically and chemically adsorbed water, and O bridge-hydroxyl groups on alumina |
氧化铝的酸性位伴随羟基的移去而产生, γ -Al2O3的许多重要催化特性都与这些酸性位有关[16, 18]。氧化铝表面羟基被认为是其B酸中心, 氧化铝表面相邻的两个羟基受热脱水后构成Al-O-Al桥键是其L酸中心。Peri J B[19]认为氧离子构成了氧化铝(100)晶面的第一层, 铝离子和氧离子按氧化铝中Al-O物质的量比构成第二层。完全水合后, 每个铝离子连接一个羟基, 受热脱水时, 羟基两两缩合脱除一分子水, 并在氧化铝表面形成一个裸露的铝离子, 其可以吸附水、氨等多电子化合物, 因此呈现出L酸特征, 当其与羟基相连时则表现出B酸特征。
最初, Peri J B[19]将氧化铝表面羟基分为5类, 对于干燥的氧化铝(100)面, 表层只有O2-, 其在低温下水合后形成单层OH-, 随着脱水, 相邻OH-随机两两反应, 生成水和O桥, 该过程形成如图4和表2所示。5种散布于氧化铝表面的OH, 残留的OH只有在800 ℃以上才能继续消除, 并导致比表面积降低、氧化铝相变, 且会在氧化铝表面形成缺陷位, 其表面酸性也从B酸转变成L酸。
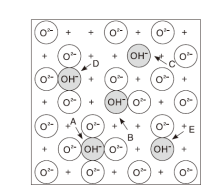 | 图4 氧化铝(100)面OH种类-Peri模型(+表示第二层中裸露的Al3+)Figure 4 Types of isolated hydroxyl ions-Peri model(+denotes Al3 in lower layer) |
| 表2 氧化铝表面OH种类及其红外谱图中平均峰频率 Table 2 Spectral position and assignment for surface hydroxyl groups on transitional aluminas |
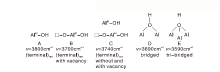
Peri模型只涉及到氧化铝(100)面, 并认定其表面只有AlIV, 而氧化铝尖晶石中还含有AlVI, 为此, Tsyganenko A A等[20, 21]结合红外谱图将氧化物表面羟基模型发展出Tsyganenko模型, 如表2和图5所示, OH键分为4类:线型(Terminal, Linear TypeⅠ a和Bent TypeⅠ b), 桥型(Bridged, TypeⅡ ), 三桥型(Tri-bridged, Type Ⅲ )和偕型(Geminal)。
氧化铝可能暴露有3种晶面, (100)面, (110)面和(111)面, 且其表面存在对氧化铝表面OH影响极为复杂的阳离子空穴[22, 23, 24], 为此, Busca模型[24]将氧化铝表面OH类型分为5种, 其对应红外谱图中平均峰频率如表2和图6所示, Busca模型是目前描述氧化铝表面OH物种最全面的方法。
γ -Al2O3化学性质比较活泼, 体相中四面体、八面体空位较多, 表面铝离子配位也不饱和, 在高温和有水环境中, γ -Al2O3变得更加活泼, 接触到水即会与水结合, 液固界面发生荷电离子转移使γ -Al2O3表面水合形成氧化铝水合物。氧化铝表面化学吸附水的过程被认为是水和Al3+之间的酸碱反应, 其中L酸Al3+作为电子受体, L碱羟基作为电子供体[13]。
室温下, γ -Al2O3也会因吸水发生水合形成Al(OH)3, 见式(1), Al(OH)3形成速度和种类取决于环境温度, 暴露时间和中间体pH值[5, 6, 7, 8, 25, 26], 当pH值低于4时, 氧化铝水合主要形成无定形态的氧化铝水合物[5], 一般酸性和碱性条件下, 则分别形成三水铝石和拜耳石[25, 27, 28, 29]。水热条件下, 温度高于150 ℃时, γ -Al2O3水合产物为勃姆石[26], 见式(2), 相对于将氧化铝浸润于水中, 受限空间内水蒸汽处理的氧化铝更容易发生水合[30]。
γ -Al2O3+3H2O↔ 2Al(OH)3(1)
γ -Al2O3+H2O↔ 2γ -AlOOH(2)
Carrier X等[5]在早期研究中提出, γ -Al2O3水合过程有两种方式。第一种水合过程为氧化铝先溶解和水合氧化铝相继在氧化铝表面析出, 目前氧化物溶解过程的实质还不清楚, 但它必包含表面水合过程, 并且水合铝粒子与温度、pH值, 以及铝浓度有关。第二种水合过程是氧化铝表面Al-O键的水解。Eng P J等[31]在研究α -Al2O3 (0001)面的水合过程中发现, 氧化铝的水解可能是由于Al-O键的水解导致。最近, Aad J A等[9]研究γ -Al2O3在70 ℃水中水合行为时发现, 老化2 h的溶液中Al(Ⅲ )浓度增幅和pH值变化都比较大, 而随着老化时间增加, Al(Ⅲ )浓度和pH值最终达到平衡, γ -Al2O3表面也生成了固态Al(OH)3, 这一现象说明γ -Al2O3水合过程是氧化铝先溶解和水合氧化铝相继再析出的过程, 如式(3)和(4)所示:
Al2O3+3H2O↔ 2Al3++6OH-(3)
[Al(H2O)x(OH)y]3-y+(3-y)OH-↔ 2Al(OH)3(solid)+xH2O (4)
因γ -Al2O3应用广泛, 相关水合现象的报道较多, 但氧化铝水合并不局限于γ -Al2O3, 其他晶型(δ -Al2O3, θ -Al2O3, χ -Al2O3, κ -Al2O3和α-Al2O3)也均观察到存在水合现象[9, 31, 32, 33, 34, 35]。活性氧化铝水合会影响其表面酸性和羟基数量, Ravenelle R M等[26]指出γ -Al2O3在200 ℃水热6 h后, 其L酸总量从342 μ mol· g-1降低至42 μ mol· g-1。Li Juncheng等[6]通过红外谱图发现, γ -Al2O3在140 ℃水热处理2 h并在550 ℃焙烧后, 其表面羟基增多, 延长水热处理时间至(6~24) h, 其表面羟基显著降低。
氧化铝水合改变其形貌和织构性质, 氧化铝水合过程中, 水合氧化铝在氧化铝表面析出后作为成核质点并长大, 不仅堵塞孔道, 覆盖活性位, 而且因其质脆导致催化剂机械强度变差[9], 引起催化剂的不可逆失活[10, 11, 12]。
Al2O3体相中四面体、八面体空位较多, 表面铝离子配位也不饱和, 接触到水即会发生水合, 因此, 提高Al2O3水热稳定性主要手段有:1)在其表面生成难溶于水的物质; 2)取代Al2O3表面结合水并占有Al2O3表面所有活性位; 3)在Al2O3表面形成强抑制作用的表面键。
MgO和γ -Al2O3都极易发生水合[36], 但在Al-O四面体中引入Mg, 形成的镁铝尖晶石
张俊等[38]在活性氧化铝中引入MgO, 结果表明, MgO不仅能抑制氧化铝载体烧结, 且当其含量为质量分数0.5%时, γ -Al2O3呈现出优异的抗水合性能。但是γ -Al2O3中引入碱土金属Mg会中和其表面酸性, 增加碱性中心, 影响活性组分前驱体的分散, 对醇脱水反应具有抑制效果[39]。
能够与γ -Al2O3形成尖晶石构型的金属除Mg外, 还有La、Cu、Ni、Li、Co、Ce、Zn等[40, 41, 42]。 俞芳等[42]通过浸渍法分别将含有K、Ca、Fe、Zr、Cu、Ni、Mg、Li、Co、Ce和Zn等金属离子的硝酸盐溶液分别负载在γ -Al2O3上, 干燥后550 ℃焙烧4 h, 并在130 ℃将样品水热处理22 h, 结果发现, K和Ca对Al2O3再水合几乎无影响, 其中K还稍有促进作用, Fe有较小的抑制作用, Zr, Cu, Ni有较明显的抑制作用; Mg, Li, Co, Ce, Zn离子有很强的抑制作用。但实验中也发现改性后的γ -Al2O3均发生了一定程度的水合。纵秋云等[10]发现, 镁铝尖晶石载体的抗水合性能虽然远高于γ -Al2O3载体, 但也会发生一定程度的水合现象。Ravenelle R M等[26]也指出在γ -Al2O3上负载Ni和Pt仅能延缓γ -Al2O3发生水合。
因此, 如何在γ -Al2O3表面形成一层致密的尖晶石结构是解决γ -Al2O3水合问题的关键。但是, 在γ -Al2O3表面覆盖一层致密的尖晶石又会改变γ -Al2O3酸性, 对活性金属负载及其分散和催化性能具有较大影响。
Si改性γ -Al2O3也可以提高其抗水合性能。最初氧化物表面甲硅烷基化被人们用来提高材料表面疏水性[43], γ -Al2O3甲基硅烷化时, 其表面离子空穴和表面L酸中心Al3+会被Si占据, 硅氧烷基团受热分解, 在γ -Al2O3表面形成Si-OH, 形成Si-O-Al结构[44], 如式5所示, 在减少γ -Al2O3表面水合位点的同时可以抑制水的吸附, 有效提高其抗水合性能。
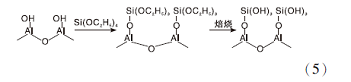
孙自谨等[45]使用正硅酸乙酯为硅源, 采用浸渍法在γ -Al2O3表面引入SiO2, 成功减少了γ -Al2O3表面暴露的Al3+, 提高了其抗水合性能, 但改性后的γ -Al2O3仅在180 ℃水热处理了2 h, 时间较短。亢丽娜等[46]发现采用SiO2改性γ -Al2O3减弱活性组分Ni与载体γ -Al2O3之间的相互作用, 导致Ni颗粒容易迁移聚集。Liu Fang等[44]也发现SiO2改性后的γ -Al2O3表面酸性大幅度降低, 难以负载上贵金属Pt, 而若对负载后的Pt/γ -Al2O3进行Si改性会带来催化剂比表面积和活性中心大幅度降低的问题。
郑金玉等[47]通过XPS和XRF技术分别对比了SiO2改性Al2O3的表面和体相硅铝比, 发现改性
综上所述, Si改性γ -Al2O3可以提高其水热稳定性, 但同时也带来两个难题:1)如何在γ -Al2O3表面形成一层致密的Si-O-Al结构; 2)Si改性改变γ -Al2O3材料表面性质, 给催化剂制备带来活性组分难以负载和良好分散的难题。
P一般用作调变γ -Al2O3表面酸性和增加其热稳定性的添加剂使用[51, 52, 53, 54], 采用磷酸溶液处理γ -Al2O3, γ -Al2O3首先发生水合(式6), 随后H2PO-4与其表面酸中心Al-OH反应生成2个酸中心磷羟基( P— OH) (式7), 增加材料总酸量[52]。当γ -Al2O3表面羟基完全被磷羟基取代, γ -Al2O3总酸量最大。进一步增加磷酸含量, 表面Al 原子连接的H2PO-4基团增多, 部分基团发生缩合, 形成多重键的结构(式8), 多重键的形成意味着γ -Al2O3表面磷羟基的减少和Al原子暴露增多, 导致其总酸量和强酸量开始下降[49]。
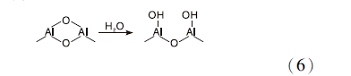
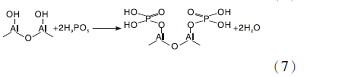
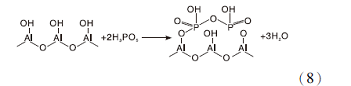
适当的磷改性γ -Al2O3后, 可以降低γ -Al2O3表面暴露的Al3+和Al-OH, 并在γ -Al2O3表面形成不溶于水的P-O-Al正四面体牢固结构, 可以有效提高γ -Al2O3的抗水合性能[55, 56]。
氧化铝具有8种同质多晶体, 活性氧化铝性质活泼, 有水环境中发生水合现象, 使其织构性质变化, 造成催化剂强度下降, 导致催化剂不可逆失活。氧化铝水合过程有两种途径:氧化铝表面Al-O键水解和表面氧化铝先溶解, 相继以水合氧化铝的形式在其表面再析出。在氧化铝表面生成难溶于水的物质, 或取代Al2O3表面结合水并占有Al2O3表面所有活性位, 或在Al2O3表面形成强抑制作用的表面键都可以提高其水热稳定性。使用能够与氧化铝形成尖晶石结构的La, Cu, Ni, Li, Co, Ce, Zn和Mg等金属对其进行改性, 可以有效延缓氧化铝水合。Si和P可以消除氧化铝表面羟基, 并在Al2O3表面形成稳定的Si-O-Al和P-O-Al结构, 可以有效提高其水热稳定性, 但Si改性会改变材料表面性质, 给催化剂制备带来活性组分难以负载和良好分散的难题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|




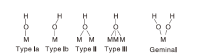
 -O-AlIV
-O-AlIV -O-AlVI
-O-AlVI