作者简介:罗杰伟,1980年生,男,四川省泸州市人,硕士,副研究员,研究方向为新型抗真菌药物的合成及药理作用。
根据α,β-不饱和醛酮亲核加成反应原理合成化合物L{[3-(4-N,N-dimethyl-pyenyl)-5-Anthracen-9-yl]-Pyrazoline}和化合物M[3-ferroceny-5-(Anthracen-9-yl)-Pyrazoline]。利用1H NMR和13C NMR对化合物进行结构表征,通过抑菌实验研究化合物抑菌生物活性。探析新型吡唑啉衍生物对革兰氏阳性菌、革兰氏阴性菌和真菌的抑菌效果,研究其结构变化对活性的影响。结果表明,化合物L和M对典型革兰氏阳性菌和典型革兰氏阴性菌有一定的抑菌效果,对真核细胞型微生物作用不明显。通过比较两者对细菌的作用结果(抑菌圈直径的大小),化合物L的抑菌作用明显强于化合物M,化合物L吡唑啉环连接N、N-二甲基苯环可能增强了抑菌生物活性。
Compound L{[3-(4-N,N-dimethyl-pyenyl)-5-Anthracen-9-yl]-Pyrazoline} and compound M[3-ferroceny-5-(Anthracen-9-yl)-Pyrazoline] were synthesized according to the nucleophilic addition reaction principle of α,β unsatur ated aldehydes and.The compounds were characterized by1H NMR and13C NMR,the antibacterial activity of compounds was studied by bacteriostasis experiments.The bacteriostatic effect of new pyrazoline derivatives on gram-positive bacteria,gram-negative bacteria and fungi was studied,and the effects of their structural changes on their activity were investigated.It was proved that compounds L and M had certain bacteriostatic effect on typical gram positive bacteria and typical gram negative bacteria,but no effect on eukaryotic cell microorganism.By comparing to the results of the bacteriostasis(diameter of bacteriostasis),the antibacterial activity of compound L was obviously stronger than that of compound M.Pyrazoline ring in L linking to N and N- two methyl benzene ring might enhance the bacteriostasis activity.
传染病仍然是当今严重威胁人类健康的疾病。在抗感染治疗中, 抗菌药物的发现及使用为人类的健康带来了福音。但随着细菌耐药性的不断出现, 甚至超级细菌的出现, 使抗菌治疗不断受到新的挑战, 人类生命受到严重威胁, 研究者也在不断寻找和研制新的抗菌药物的征途上不断进取。文献表明[1, 2, 3], 吡唑啉化合物因具有广泛的生物学活性如消炎、止痛、抗菌、抗病毒、抗肿瘤等作用而受到关注, 已经成为合成化学杀菌剂的重要研究对象, 因此吡唑啉化合物将具有非常好的应用前景。
吡唑啉化合物是一类具有广泛生物活性的物质, 此类化合物因具有如抗菌、抗炎、抗肿瘤等活性在医药生产中具有重要的用途, 长期以来受到业内关注[4]。早在19世纪后期, Fischer E等采用丙烯醛与苯肼合成出吡唑啉类化合物, 在之后的很长一段时间里, 采用α , β -烯酮类(醛)化合物与肼类化合物合成了很多吡唑啉类衍生物。自20世纪70年代Ankhiwala M D等[5]报道了某些取代的吡唑啉化合物具有优良的杀菌活性和Makino K等[6]通过实验发现在1-位氮原子上引入磺酰基可筛选出除草活性较强的化合物后, 许多新型吡唑啉类化合物在医药中的应用产生了良好的效果。吡唑啉环是不同生物活性的重要结构单元, 且取代基在环上不同位置变换可明显影响其生物活性。如杨金美等[7]报道了几种酰代吡唑啉酮金属配合物具有抑菌活性; Turan-Zitounia G等[8]发现含硫杂环2-吡唑啉化合物呈现较强的抗菌活性。此外, 王瑾玲等[9, 10]报道了一些酰基吡唑啉酮化合物和Yoshioka Koichi等[11]报道了一些吡唑烷酮类化合物也具有杀菌性能, 而赵军龙等[12, 13]报道了含二茂铁基吡唑啉具有较好的抗真菌活性。基于以上研究, 本课题组根据α , β -不饱和醛酮亲核加成反应原理合成化合物L{[3-(4-N, N-dimethyl-pyenyl)-5-Anthracen-9-yl]-Pyrazoline}和化合物M[3-ferroceny-5-(Anthr acen-9-yl)-Pyrazoline], 并利用1H NMR、13C NMR对化合物进行结构表征, 测定化合物L和化合物M对金黄色葡萄球菌、乙型溶血性链球菌、大肠杆菌、痢疾杆菌、白色念珠菌、新型隐球菌的抑菌效果。
琼脂粉, 分析纯; 蛋白胨, 北京OXOID公司; 酵母提取物, 北京OXOID公司; 沙保罗氏琼脂, 杭州滨和微生物试剂有限公司。其余所用试剂均为化学纯或分析纯, 实验用水为二次蒸馏水。
金黄色葡萄球菌(ATCC 6538)、乙型溶血性链球菌、大肠杆菌(8099)、痢疾杆菌、白色念珠菌和新型隐球菌均由川北医学院病原实验中心提供。
恒温空气浴摇床, 哈尔滨市东明医疗仪器厂; 生物安全柜, 美国BIO-RAD公司; SHP-150型生化培养箱, 上海精宏实验设备有限公司; 标准细菌比浊管, 北京哲成科技有限公司。
1.3.1 化合物L的合成与结构表征
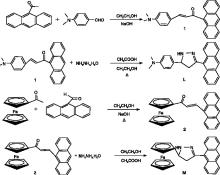
氮气保护下将化合物1(参考文献[14]的方法合成)(2.55 g、7.1 mmol)加入20 mL无水乙醇与5 mL冰乙酸混合液中, 缓慢滴加水合肼(0.82 g、16.4 mmol), 常温搅拌30 min使其混合均匀。加热至70 ℃回流8 h, 冷却至常温, 用CH2Cl2萃取3次, 合并有机相, 无水Na2SO4干燥, 经旋转蒸发仪蒸干得黄色固体, 粗品经柱层析纯化(石油醚与乙酸乙酯体积比为4:1), 得到黄色粉末状物质1.02 g, 产率为40%, 熔点为(180~184) ℃。
将化合物L提纯, 充分干燥, 选择CDCl3为氘代溶剂, 将带有样品的核磁管装入核磁测定仪器中, 锁定氘代溶剂吸收峰, 扫描并收集信号。1H NMR(CDCl3, 400 MHz)δ (ppm):3.0(s, J=5.5 Hz, 6H, -CH3), 5.25(s, 1H, -CH-), 6.61(d, 2H, -CH2-), 7.15(s, 1H, Ar-H, ), 7.28(d, 2H, Ar-H), 7.42~7.58(m, 5H, Ar-H), 7.95(d, 2H, Ar-H), 8.15(d, 2H, Ar-H), 8.55(s, 1H, Ar-H)。13C NMR(CDCl3, 400 MHz)δ (ppm):40.07, 111.67, 121.76, 124.31~135.54, 149.36, 152.27, 200.01。
将化合物L提纯, 充分干燥, 溴化钾进行压片, 设置傅里叶红外光谱仪狭缝宽度和波长参数后, 放入样品开始扫描, 处理图像。IR(KBr):3 434 cm-1(-NH-), 2 919 cm-1(-CH2-), 1 589 cm-1(-C=N-), 1 520 cm-1(Ar), 963 cm-1(Ar-H), 817 cm-1(Ar-H), 698 cm-1(Ar-H)。
1.3.2 化合物M的合成与结构表征
氮气环境下将化合物2(参考文献[14]的方法合成)(2.68 g、7.1 mmol)加入20 mL无水乙醇和5 mL冰乙酸的混合液中, 缓慢滴加水合肼(0.81 g, 16.4 mmol), 常温搅拌30 min使其混合均匀。加热至70 ℃回流8 h, 冷却至常温, 用CH2Cl2萃取3次, 合并有机相, 无水Na2SO4干燥, 经旋转蒸发仪蒸干, 粗品经柱层析纯化(石油醚与乙酸乙酯体积比为3:1), 得到黄色固1.52 g, 产率为56.72%, 熔点为(250~255) ℃。
化合物M的氢谱(1H NMR)、碳普(13C NMR)和红外光谱(IR)测定方法与化合物L结构表征方法相同:1H NMR(CDCl3, 400 MHz)δ (ppm):2.36(s, 2H, -CH2-), 3.44(m, 1H, =CH-), 3.85(m, 1H, =CH-), 4.26(s, 5H, =CH-, -CH-), 4.46(m, 1H, =CH-), 4.59(t, 1H, =CH-), 4.83(t, 1H, -CH-), 6.81(m, 1H, -NH-), 7.55(m, 4H, Ar-H), 7.95~8.05(m, 3H, Ar-H), 8.45(s, 1H, Ar-H), 8.53(d, 1H, Ar-H)。13C NMR(CDCl3, 400 MHz)δ (ppm):21.95, 43.03, 55.53, 67.19, 67.90, 69.58, 70.27, 70.67, 123.14~133.19, 155.96, 169.41。
IR(KBr):3 435 cm-1(-NH-), 2 919 cm-1(-CH2-), 1 663 cm-1(-C=N-), 1 493 cm-1(Ar), 1 407 cm-1(C=C), 1 102 cm-1(=C-H), 731 cm-1(Ar-H), 492 cm-1(Fe-Cp)。
1.4.1 制备LB培养液及LB平板
按照LB培养液的常规制作方法, 分别称取蛋白胨和酵母提取物, 加入三角烧瓶中, 加双蒸水(DW)100 mL加热溶解后, 再加双蒸水, 调节pH值, 按需分装后高压灭菌(15磅, 15 min), 即制得LB培养液。
称取2 g琼脂粉放入加有100 mL的LB培养液的三角烧瓶中, 高压灭菌(15磅, 15 min), 取出后稍冷倒板, 即制得LB平板, 备用。相似方法制备沙氏培养基及血清平板。
1.4.2 配备药物溶液
将化合物L与化合物M干燥, 称取0.037 5 g化合物L和0.043 2 g化合物M, 置于100 mL容量瓶中, 加乙腈溶解, 制备成浓度1.0× 10-3mol· L-1储备液, 4 ℃保存备用。
1.4.3 制备菌悬液
将-70 ℃保存的金黄色葡萄球菌、乙型溶血性链球菌、大肠杆菌、痢疾杆菌、白色念珠菌和新型隐球菌菌种取出, 室温解冻。接种环焚烧灭菌分别取细菌分区划线接种于适宜平板, 37 ℃培养18 h, 用无菌接种环取单个菌落接种于5 mL的LB培养液中, 37 ℃水浴, 180 rpm振摇培养18 h。参照标准细菌比浊管, 用无菌pH=7.2磷酸盐缓冲液(PBS液)制备成菌浓度(5.0× 105~5.0× 106) cfu· mL-1的菌悬液[15]。
1.4.4 抑菌实验
分别取0.1 mL菌悬液均匀涂布于适宜平板表面, 自然干燥, 每个平板放置两个牛津杯, 轻压固定, 分别吸取0.2 mL化合物L的乙腈溶液及化合物M的乙腈溶液加入不同的牛津杯中, 37 ℃培养20 h后观察细菌生长情况, 测量抑菌圈的直径[16]。试验同时设置乙腈溶液作用组、正常LB培养液对照组。实验重复3次, 取平均值。
化合物L与化合物M对不同微生物的抑菌效果观察结果如表1所示。
| 表1 化合物L与化合物M对不同微生物的抑菌效果观察结果 Table 1 Bacteriostatic effect observation results of compounds L and M on different microorganisms |
表1的抑菌结果显示, 空白乙腈作用组、LB培养液对照组的细菌生长良好, 细菌生长未受影响; 化合物L对金黄色葡萄球菌、乙型溶血性链球菌、大肠杆菌、痢疾杆菌均有一定的抑菌作用, 且对金黄色葡萄球菌、乙型溶血性链球菌的抑菌作用强于大肠杆菌和痢疾杆菌。化合物M对金黄色葡萄球菌、乙型溶血性链球菌和大肠杆菌和痢疾杆菌也有一定的抑菌作用, 其抑制金黄色葡萄球菌、乙型溶血性链球菌的作用略强于大肠杆菌、痢疾杆菌。比较两者对细菌的作用结果(抑菌圈直径的大小), 化合物L的抑菌作用明显强于化合物M, 原因可能是化合物L的吡唑啉环连接N、N-二甲基苯环增强了抑菌活性。两种化合物对白色念珠菌和新型隐球菌(真菌)均无抑制作用。
(1) 吡唑啉化合物对多种细菌均有不同程度的抑制作用, 抑菌机理主要是抑制菌体糖及代谢中间产物的氧化和脱氢, 并能抑制蛋白和核酸的合成, 可避免临床上某些抗菌素的毒副反应及耐药性。抗菌实验显示, 化合物L的抑菌作用明显强于化合物M, 原因可能是化合物L的吡唑啉环连接N、N-二甲基苯环增强了抑菌活性。
(2) 金黄色葡萄球菌、乙型溶血性链球菌是一种典型的革兰氏阳性菌; 大肠杆菌、痢疾杆菌是革兰氏阴性菌的代表; 而白色念珠菌、新型隐球菌则是一种单细胞真菌。实验结果显示, 化合物L和化合物M对典型革兰氏阳性菌和典型革兰氏阴性菌有一定的抑菌效果, 对真核细胞型微生物作用不明显。但由于化合物L的乙腈溶解性及水溶解性均较化合物M差, 表明化合物L的实际抑菌效果可能比实验结果还要强一些。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|