作者简介:纵宇浩,1987年生,男,安徽省宿州市人,硕士,工程师,从事脱硝催化剂开发及研究。
烟气中的汞污染是燃煤电厂污染源之一,将烟气中的Hg0氧化脱除是脱汞的重要思路。采用光化学鼓泡反应器研究UV/H2O2高级氧化工艺脱汞过程,结果表明,增加UV的功率可以提高Hg0去除率;随着H2O2浓度提高,Hg0去除率先上升后趋于下降;随着Hg0初始浓度提高,Hg0去除率呈下降趋势;而Hg0去除率与溶液体积成正比。该UV/H2O2高级氧化工艺可为燃煤电厂烟气脱汞提供新思路。
Mercury pollution in flue gas is one of the pollution sources of coal-fired power plants.Oxidation of Hg0 in flue gas is an important idea for mercury removal.In this paper,the photochemical bubbling reactor was used to study the mercury removal process of UV/H2O2 advanced oxidation process.The results showed that increasing UV power could increase Hg0 removal rate;The removal rate of Hg0 increased with H2O2 concentration increasing at first and then decreased;With the increase of Hg0 initial concentration,the removal rate of Hg0 showed a downward trend;The removal rate of Hg0 was proportional to the volume of solution.Therefore,the process can provide a new idea for mercury removal from coal-fired power plants.
汞(Hg)作为一种挥发性强、生物累积效应明显的剧毒重金属, 会给人类健康、生态环境和经济建设带来极大危害, 如何有效控制燃煤和垃圾焚烧烟气中的汞排放是一个重要课题[1]。从形态分布看, 烟气中的汞主要有3种存在形式, 即单质汞(Hg0)、氧化态汞(Hg2+)和颗粒态汞(HgP)。其形态与烟气温度以及成分如飞灰、SO2、NOx、卤族元素等因素有关, Hg0挥发性强, 水溶性低, 性质稳定, 难以利用烟气除尘或脱硫装置实现捕集[2]; Hg2+易吸附于颗粒物且易溶于水, 易于利用烟气污染物控制装置加以脱除; HgP如HgCl2、HgO、HgSO4及HgS等可吸附于飞灰上被除尘装置捕集。可见, 设法将Hg0氧化脱除是烟气脱汞的重要思路[3]。
随着基础科学的发展以及多学科跨领域的交叉渗透, 研究者利用多种物理化学交叉手段开发出多种以羟基自由基(· OH)为代表的高级氧化工艺[4, 5, 6]。表1列出几种常见氧化物的氧化电位。
| 表1 常见氧化物的氧化电位 Table 1 Oxidation potential of common oxides |
从表1可见, · OH不但具有极强的氧化能力(氧化电位高达2.80 eV, 仅次于氟的2.87 eV), 还具有环保性和无选择性, 与大部分有机污染物的反应速率常数达(1× 107~1× 108) mol· (L· s)-1, 能够轻易攻击各种污染物并将其降解为无害产物, 目前已在有机物水处理领域得到广泛研究。在烟气净化领域, 高级氧化烟气净化技术因氧化能力强、洁净环保以及具有多污染一体化脱除的潜力而逐步得到重视和发展[7, 8, 9]。
UV(紫外光)/H2O2高级氧化工艺能够释放大量· OH自由基, 无选择性地攻击并降解不同污染物[10, 11], 且具有工艺流程简单、设备成熟可靠和洁净环保等优势, 已在化工和环保等水处理领域得到广泛的研究与应用, 但将UV/H2O2高级氧化工艺应用于烟气中Hg0的氧化脱除还相当罕见。本试验在自制的光化学反应器中, 应用UV/H2O2高级氧化工艺脱除模拟烟气中的Hg0, 并对脱除过程的工艺参数进行系统而深入的研究, 为该技术的Hg0脱除以及最终的工业应用提供理论基础, 同时也有利于促进光化学与能源化学的交叉发展, 丰富燃煤烟气和垃圾焚烧烟气Hg0脱除技术[12]。
一般认为, UV/H2O2高级氧化工艺降解污染物的反应机理是:(1)UV对污染物直接激发分解, 即通过有效的紫外光光子直接激发污染物分子键的解离而发生光降解; (2)H2O2对污染物直接进行氧化分解; (3)· OH自由基的间接氧化, H2O2在一定波长紫外光照射下分解, 并释放出具有强氧化能力的· OH自由基, 然后由· OH自由基将目标污染物氧化降解。这3种反应途径中, · OH自由基的间接氧化一般占主导作用。H2O2在一定波长紫外光照射下的分解反应如下[13, 14, 15]:
H2O2+hν → · OH (1)
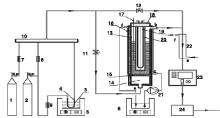
在自制光化学鼓泡反应器上进行UV/H2O2高级氧化工艺氧化脱汞试验, 整个试验装置由烟气模拟部分、反应器部分和尾气分析部分组成。试验系统流程如图1所示。
2.2.1 烟气模拟部分
试验采用钢瓶标准气1和2(南京特种气体厂)模拟实际烟气, N2和O2均为高纯气, 汞蒸气的发生主要依靠恒温水浴5、U型管4、置于U形管中的汞渗透管3以及从气瓶2来的高纯N2载气。汞渗透管3(美国VICI Metronics公司)是汞蒸气发生源, 原理主要是利用渗透管内气态和液态两相汞的动态平衡, 汞蒸气在某一温度以一定的渗透率渗透, 再以恒定流量的高纯N2载气携带出来, 在一定温度和恒定流量载气条件下可形成浓度稳定的汞蒸气。试验中高纯N2载气流量为150 mL· min-1, 用恒温水浴5控温以维持稳定蒸发。汞渗透管的稳定需要较长时间, 两次试验的间歇过程中, 停止水浴加热, 并保持稳定的载气流量, 可在下次试验开始时较快达到汞渗透管稳定状态。试验中控制模拟烟气总流量为2 L· min-1, 各路气体在气体混合器10中混合均匀后进入后面的反应器部分。汞蒸气经过的管路均有加热带缠绕, 以防止汞蒸气在管壁冷凝。
2.2.2 反应器部分
反应器部分的核心部件是定制的带换热外套的光化学鼓泡反应器13, 其主体由有机玻璃制成, 反应器内径50 mm, 风室14高度200 mm, 布风板15以上高度500 mm; 使用过滤精度为20 μ m的金属粉末烧结板为布风板, 布风板直径50 mm, 厚度8 mm。紫外灯19(南京华强电子有限公司)的灯管直径为20 mm、长330 mm, 有15 W和25 W两种功率, 主波长254.7 nm。紫外灯套上高透光率的石英套管20后置于光化学鼓泡反应器内。恒温水浴6结合换热液循环泵进行温控, 温度由水银温度计测定。
2.2.3 尾气分析部分
烟气中单质汞含量由VM-3000型汞分析仪23(德国Mercury Instruments公司)测量, 在烟气进入汞分析仪之前首先由冷凝器冷凝去除其中的水分, 以避免水分对仪器影响和损伤。通过调节阀门11和12的开关分别测量烟气中Hg0的初始浓度和反应后尾气中的残留浓度。在试验系统的末端设置有活性炭吸附箱24吸附尾气中剩余的汞, 防止二次污染。
2.2.4 化学试剂
试验所用化学试剂为30%H2O2, 分析纯; 去离子水。
首先关闭阀门11, 打开阀门12, 调节恒温水浴5至一定温度以维持汞渗透管的稳定蒸发, 并调节流量计7~9以满足不同配比要求, 其中维持通过流量计9的高纯N2载气流量为150 mL· min-1, 通过汞分析仪观察烟气中Hg0浓度的变化; 与此同时, 将配制好的H2O2溶液加入光化学鼓泡反应器中布风板以上的空间, 通过调节恒温水浴6结合换热液循环泵21对反应器进行控温。待烟气中的汞蒸气浓度和反应器温度均稳定后, 打开阀门11, 关闭阀门12, 使烟气进入光化学鼓泡反应器中, 预通一段时间待气体流态稳定后, 打开紫外灯19开始记录数据。
试验中, 通过汞分析仪每隔2 min记录1次尾气中Hg0浓度的数据, 每次试验进行30 min。
每次试验可记录15个数据, 将15个数据取平均值作为尾气中Hg0的最终浓度, 烟气中Hg0去除率由下式计算:
η =
式中, η 为Hg0去除率, %; cin为烟气中Hg0初始浓度, μ g· m-3; cout为尾气中Hg0浓度, μ g· m-3。
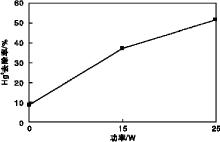
紫外灯功率对Hg0去除率的影响如图2所示, 烟气总流量为2 L· min-1, 恒温水浴5维持80 ℃, O2体积分数为6%, H2O2溶液体积600 mL, H2O2初始浓度1.5 mol· L-1, 溶液温度30 ℃。
由图2可见, 没有紫外灯, 即紫外灯功率为0 W, 仅依靠H2O2对Hg0直接氧化时, Hg0去除率为8.7%, 可见H2O2对Hg0的氧化能力较弱, Hg0去除率很低; 当引入紫外灯后, Hg0去除率明显增加(紫外灯功率为15 W时, Hg0去除率37.2%), 表明紫外光在UV/H2O2高级氧化工艺中扮演重要作用, H2O2在一定波长的紫外光辐照下能够发生反应(1), 释放出大量氧化性极强的· OH自由基, · OH自由基通过氧化反应有效脱除Hg0, 因此, 紫外灯的引入使得Hg0去除率显著增加[16]; 当紫外灯功率由15 W增加到25 W时, Hg0去除率由37.2%增加到51.6%, 紫外灯功率的增加意味着在单位时间内能够产生更多有效的光量子, 使得更多的H2O2受激发分解出· OH自由基, Hg0去除率增加。
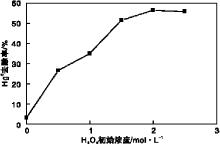
H2O2初始浓度对Hg0去除率的影响如图3所示。烟气总流量为2 L· min-1, 紫外灯功率为25 W, 恒温水浴5维持80 ℃, O2体积分数为6%, H2O2溶液体积600 mL, 溶液温度30 ℃。由图3可以看出, 当H2O2初始浓度为0时, Hg0去除率极低(3.1%), 可见紫外光对Hg0的激发氧化效果微乎其微; 当有H2O2加入时, Hg0去除率大幅增加, 结合前面的结论可知, 在UV/H2O2高级氧化工艺氧化脱汞试验中, 起氧化作用的主要是H2O2光解产生的· OH自由基; 当H2O2初始浓度从0.5 mol· L-1增加到1.5 mol· L-1时, Hg0去除率从26.6%增加到51.6%, 继续增加H2O2初始浓度, Hg0去除率增加幅度显著减小[17], 最终出现下降趋势(51.6%→ 56.5%→ 55.9%)。出现这种现象可能的原因是:(1)当H2O2初始浓度比较低时, H2O2光解产生的· OH自由基也相较少, 此时主要发生反应(1), 当H2O2初始浓度增加时, · OH自由基产量也相应增加, 使得Hg0去除率增加; (2)当H2O2初始浓度升高到一定程度时, 系统过多的H2O2和· OH自由基将参与到一系列的副反应中。
过多的H2O2在作为· OH自由基发生剂的同时也扮演着· OH自由基猝灭剂的角色, 系统过多的H2O2和· OH自由基之间会发生如下反应[18, 19]:
2H2O2+· OH→ · HO2+H2O (2)
· OH+· HO2→ H2O+O2 (3)
这两个副反应将极大地消耗H2O2和· OH自由基, 另外, 反应(2)产生的· HO2自由基的氧化能力(1.60 eV)比· OH自由基(2.80 eV)低很多, 对Hg0的氧化能力远低于· OH自由基。
过多的· OH自由基之间也会相互结合重新生成H2O2, 使系统氧化能力大大降低:
2· OH→ H2O2 (4)
这些副反应使得Hg0去除率增加幅度显著减小, 并且最终出现下降的趋势。
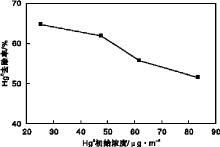
Hg0初始浓度对Hg0去除率的影响如图4所示。紫外灯功率25 W, 烟气总流量2 L· min-1, O2体积分数6%, H2O2溶液体积600 mL, H2O2初始浓度为1.5 mol· L-1, 溶液温度30 ℃。试验中通过调节恒温水浴5的温度得到不同的Hg0初始浓度。由图4可见, Hg0去除率随着Hg0初始浓度的增加而下降, 其可能的原因是:当紫外灯功率一定时, 系统· OH自由基的产量相对稳定, 而Hg0初始浓度的增加势必造成目标污染物的量增多, · OH自由基与Hg0的比例下降, 使得Hg0去除率随着Hg0初始浓度的增加而下降[20]。
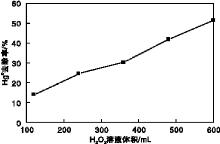
H2O2溶液体积对Hg0去除率的影响如图5所示。紫外灯功率25 W, 烟气总流量为2 L· min-1, 恒温水浴5维持80 ℃, O2体积分数6%, H2O2初始浓度为1.5 mol· L-1, 溶液温度30 ℃。
由图5可以看出, Hg0去除率随着H2O2溶液体积的增加而上升, 当H2O2溶液体积由120 mL增加到600 mL时, Hg0去除率由14.1%增加到51.6%。造成这种现象可能的原因是:(1)H2O2溶液体积增加而H2O2初始浓度保持不变时, H2O2总量增多, 使得· OH自由基产量随之增多, · OH自由基与Hg0比例上升, 导致Hg0去除率增加; (2)H2O2溶液体积的增加, 使得烟气与溶液的接触时间相应增加, 有利于改善气液接触条件, 增强气液传质效率, 使反应更加充分, 最终使Hg0去除率上升。
(1) UV/H2O2高级氧化工艺作为一种新型技术, 可以有效去除烟气中的部分Hg0。
(2) 研究了3种紫外灯功率(0 W、15 W以及25 W)下的Hg0去除率, 结果表明, 紫外灯的引入可以显著提高Hg0去除率, 并且25 W紫外灯较之15 W紫外灯对Hg0的去除效果要好。
(3) 研究了不同H2O2初始浓度下的Hg0去除率, 结果表明, 当H2O2初始浓度较低时, Hg0去除率随着H2O2初始浓度的增加而上升; 但是当H2O2初始浓度增加到一定程度后, Hg0去除率的上升幅度显著降低直至出现下降的趋势。
(4) 通过调节恒温水浴5的温度研究了不同Hg0初始浓度下的Hg0去除率, 结果表明, Hg0去除率随着Hg0初始浓度的增加而下降。
(5) 研究了不同H2O2溶液体积下的Hg0去除率, 结果表明, Hg0去除率随着H2O2溶液体积的增加而上升。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|