作者简介:刘晓菊,1985年生,女,汉,陕西省榆林市,硕士,主要从事有机合成研究。
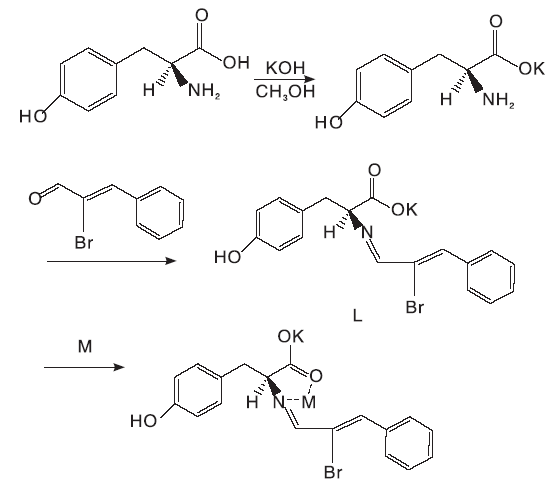
以L-酪氨酸(L-Tyrosine)与溴肉桂醛为原料,首先合成了具有手性的新型席夫碱配体L、然后分别与乙酸铅和五水硫酸铜进行配位反应,生成了C18H15BrCuKNO7S和C22H21BrKNO7Pb两种新的氨基酸衍生物金属络合物。利用红外光谱、紫外光谱、质谱和荧光等进行表征和性质研究。结果表明,配体L在紫外区和可见区均可以作为光催化剂材料,配合物 C22H21BrKNO7Pb只适合作为紫外光区的光催化剂材料。而C18H15BrCuKNO7S络合产物不适合作为光催化剂材料。
In this paper,L-tyrosine and bromocinnamaldehyde were selected as raw materials for the first time.Firstly the chiral novel schiff base ligand L was synthesized and then coordinated with(CH3COO)2Pb·H2O and CuSO4·5H2O to get C18H15BrCuKNO7S and C22H21BrKNO7Pb.The characteristic and the properties of the two metal complexes of amino acid derivatives were studied by IR,ultraviolet spectroscopy,mass spectrometry and fluorescence analysis.We speculated that L could be used as photocatalyst materials in both the ultraviolet and visible regions,and the C22H21BrKNO7Pb was only suitable for photocatalyst materials in the ultraviolet region.The C18H15BrCuKNO7S was not suitable for photocatalyst.
氨基酸席夫碱及其金属配合物具有特殊的生理活性从而受到广泛重视[1]。现已报道腙类、氨基酸类、缩胺脲类、胍类、缩胺类席夫碱及其相应的金属配合物[2]具有抗癌、抗病毒、灭菌等特殊的药理作用[3]。由于氨基酸席夫碱配合物有很强的细胞穿透性和脂溶性[4], 所以它的抗菌性能不易产生耐药性。氨基酸席夫碱化合物可以广泛用于探测和识别金属离子[5]。
本文以L-酪氨酸(L-tyrosine) 和溴肉桂醛为原料, 合成新型的具有手性的席夫碱配体L, 然后配体L分别与(CH3COO)2Pb·H2O和CuSO4·5H2O进行配位反应, 得到两种新型的金属配合物, 目标产物用IR、荧光分光光度计和元素分析仪等表征其结构, 并用紫外漫反射光谱测试其光催化性质, 在可见光照射下, 考察配体 C18H15BrKNO3和金属配位化合物C22H21BrKNO7Pb和C18H15BrCuKNO7S的催化性能。
TU-1201紫外可见分光光度计, 北京普析通用仪器有限责任公司; RF-5301PC荧光分光光度计, 日本岛津公司; AXIMA-CFR plus MALDI-TOP Mass Spectrometer飞行质谱仪, 岛津集团英国克雷斯托分析仪器公司; 德国艾乐曼VarioEL Ⅲ 元素分析仪; EQUINOX-55傅立叶红外光谱仪, 德国布鲁克公司, 干燥KBr压片。试剂为市售分析纯试剂, 溶剂为市售工业级试剂, 并对所有溶剂进行无水处理; 用自制的薄层色板。
1.2.1 L-酪氨酸与溴肉桂醛合成席夫碱配体(L)
在圆底烧瓶中加入1 mmol(0.181 g)L-酪氨酸、15 mL无水乙醇和转子, 将圆底烧瓶放入硅油加热炉中加热至80 ℃, 待液体变均匀时, 加入1 mmol(0.062 g)KOH, 反应1 h液体由浑浊变为透明, 加入1 mmol(0.211 g)溴肉桂醛, 液体变为墨绿色, 继续反应2 h, 液体由墨绿色变为浅绿色浑浊液体, 继续反应1 h液体颜色不变, 停止反应。冷却后过滤, 滤纸上有浅绿色固体0.23 g。产率55%; IR(KBr, cm-1) υ :1 631、2 950、2 940、2 878、2 810、2 657、2 610、1 600、1 507。LC-MS(M+1)C18H15BrKNO3理论值:410.99, 实验值412.40。C18H15BrKNO3元素理论值(%):C, 52.43; H, 3.67; Br, 19.38; K, 9.48; N, 3.40; O, 11.64; 实验值(%):C, 52.43; H, 3.67; Br, 19.38; K, 9.48; N, 3.40; O, 11.64。
1.2.2 席夫碱配体(L)与乙酸铅的配位反应
在三颈烧瓶中加入席夫碱配体(L)0.412 g(1 mmol)和10 mL甲醇, 加热搅拌使其全部溶解, 加入 0.379 g(1 mmol)(CH3COO)2Pb·H2O, 反应2 h后, 液体变为绿色, 继续反应1 h, 液体颜色变深, 停止反应。等液体冷却后过滤, 滤纸上有深绿色粉末0.29 g。产率40%; IR(KBr, cm-1)ν :1 616, 565, 487。C22H21BrKNO7Pb元素理论值:C, 35.82; H, 2.87; Br, 10.83; K, 5.30; N, 1.90; O, 15.18; Pb, 28.09; 实验值:C, 35.80; H, 2.89; Br, 10.80; K, 5.33; N, 1.99; O, 15.10; Pb, 28.08。
1.2.3 席夫碱配体(L)与五水硫酸铜的配位反应
在三颈烧瓶中加入席夫碱配体(L)0.412 g(1 mmol)和10 mL甲醇, 加热搅拌使其全部溶解, 加入0.249 g(1 mmol)CuSO4·5H2O, 反应2 h后, 液体变为绿色, 继续反应1 h, 停止反应。液体冷却后过滤, 滤纸上有墨绿色固体0.20 g。产率:35%; IR(KBr, cm-1), ν :1611, 535, 474; C18H15BrCuKNO7S元素理论值(%):C, 37.80; H, 2.64; Br, 13.97; Cu, 11.11; K, 6.84; N, 2.45; O, 19.58; S, 5.61; 实验值(%):C, 37.70; H, 2.70; Br, 13.99; Cu, 11.13; K, 6.80; N, 2.49; O, 19.60; S, 5.59。
席夫碱L在1 631 cm-1有明显的C=N伸缩振动峰, 2 950 cm-1、2 940 cm-1为-CH3伸缩振动峰, 2 878 cm-1、2 810 cm-1为-CH2-的伸缩振动峰, 2 657 cm-1、2 610 cm-1为-CH-的伸缩振动峰, 1 600 cm-1和 1 507cm-1为苯环的骨架伸缩振动峰, 表明 L-酪氨酸与溴肉桂醛反应发生了缩合反应生成目标产物席夫碱。配体L与乙酸铅络合的产物在1 616 cm-1处有明显的C=N伸缩振动峰出现, 而配体L在1 631 cm-1有明显的C=N伸缩振动峰, 说明金属与C=N键中的N原子络合, 导致C=N伸缩振动峰蓝移, 且在 565 cm-1处有O-Pb出现, 在487 cm-1处有N-Pb的出现, 说明配体L与乙酸铅发生了络合。配体L与五水硫酸铜络合的产物在1 611 cm-1处有明显的C=N伸缩振动峰出现, 而配体L在1 631 cm-1有明显的C=N伸缩振动峰, 说明金属与C=N键中的N原子络合, 导致C=N伸缩振动峰蓝移, 且在535 cm-1处有O-Cu出现, 在474 cm-1处有N-Cu的出现, 说明配体L与五水硫酸铜发生了络合。
目标化合物的荧光光谱图如图1所示。
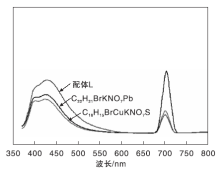 | 图1 目标化合物在甲醇/水(体积比1:1)溶液中荧光光谱图 浓度5× 10-6mol·L-1, 激发波长397 nmFigure 1 Fluorescence emission spectra of the title complexes in CH3OH/H2O(V:V=1:1) solution |
由图1可知, 配体L有三个荧光发射峰, 分别在401 nm、449 nm和708 nm, 配体L与五水硫酸铜络合的产物C18H15BrCuKNO7S有三个发射峰, 分别为401 nm、440 nm和705 nm, 无明显的偏移。配体L与乙酸铅络合的产物C22H21BrKNO7Pb出现了三个发射峰, 分别在400 nm、442 nm和704 nm, 无明显偏移。配合物的荧光强度都较配体L降低, 这与红外, 紫外和紫外漫反射结果一致。
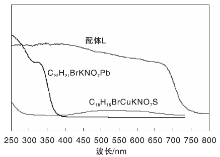
目标化合物紫外漫反射吸收光谱如图2所示。
由图2可知, 配体L在(250~800) nm均有紫外吸收。C22H21BrKNO7Pb在(250~400) nm有紫外吸收, 在可见光区没有吸收, C18H15BrCuKNO7S在紫外区和可见区均没有吸收, 推测配体L可以作为光催化剂材料, 配体L与乙酸铅络合的产物C22H21BrKNO7Pb适合作为紫外光区的光催化剂材料。而配体L与五水硫酸铜络合的产物C18H15BrCuKNO7S不适合作为光催化剂材料。
以L-酪氨酸和溴肉桂醛为原料, 合成新型的具有手性席夫碱配体L, 然后配体L分别与乙酸铅和五水硫酸铜进行配位反应, 得到两种新型的具有手性的席夫碱金属配合物 C22H21BrKNO7Pb和C18H15BrCuKNO7S。用红外光谱及元素分析表征和确认化合物的结构, 用紫外漫反射吸收研究了其性质, 数据表明配体L可作紫外区和可见区的光催化剂材料, 配合物 C22H21BrKNO7Pb只适合作为紫外光区的光催化剂材料, 而C18H15BrCuKNO7S不适合作为光催化剂材料。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|