作者简介:李佳霖,1995年生,女,硕士,研究方向为催化合成技术。E-mail:630096897@qq.com
化学催化法是实现氨基酸脱羧反应的关键科学途径,使用自制的Ru/TiO2催化剂对L-赖氨酸进行脱羧反应,研究还原温度对催化剂活性的影响,发现500 ℃还原的催化剂具有最高的脱羧活性。通过反应条件优化,表明低于6 MPa和8 h,选择性和转化率随初始压力和反应时间增加而增加,继续增加压力和反应时间则发生脱氨副反应,选择性降低;磷酸与L-赖氨酸物质的量比为3时,有利于1,5-戊二胺的生成。
Chemical catalysts for amino acids decarboxylation have promising application prospects.In this study,home-made Ru/TiO2 catalysts were used for L-lysine decarboxylation reaction.And the influence of reduction temperature was systematically investigated.Catalyst reduced at 500 ℃ had best decarboxylationactivity.The results showed that conversion and selectivity increased with the increasing of initial reaction pressure and reaction time when pressure was lower than 6 MPa,reaction reaction time was less than 8 h.Then,selevtity decreased to continue to increasereaction pressure and time because of deamination side reaction.It was favorable for decarboxylation of amino acids to add 3 times of phosphoric acid.
氨基酸脱羧是重要的生物质资源, 也是合成复杂有机体极具吸引力的生物基材料, 通过氨基酸催化转化制备胺及胺的衍生物是生物质再生利用的重要途径, 一些氨基酸可以通过脱羧直接获得具有高反应活性的多元胺, 在生物、医药、农药和材料等领域发挥不可替代的作用[1, 2]。
酶在氨基酸化学中具有重要地位, 早在20世纪50年代, 就有报道利用谷氨酸棒状杆菌和黄精短杆菌生产L-谷氨酸, 目前生物发酵法仍然是制备大多数氨基酸的重要手段。德、日和韩等国科学家都对L-赖氨酸酶催化脱羧反应过程及相关性能进行了研究。秀崎友则等[3]和Lee K H等[4]利用表达赖氨酸脱氢酶的大肠杆菌催化72 h, 对L-赖氨酸盐酸盐催化, 构建戊二胺工程菌, 提高了戊二胺产量。生物酶能够对特定底物进行脱羧, 实现反应物的定向转化。然而, 酶催化反应中, 蛋白酶的环境耐受性较差, 容易受金属毒化作用而失活, 同时需要添加昂贵的辅因子并且严格控制反应体系的pH, 工业化存在很大挑战。
化学催化法是实现氨基酸脱羧反应的关键科学途径, 按照化学催化体系的相态分类, 氨基酸脱羧反应可以分为均相催化和多相催化。均相催化剂普遍负载量高, 具有催化剂稳定性差和产物难分离的缺点; 非均相催化剂具有容易分离、催化剂稳定性高和容易连续操作等特点, 是未来氨基酸脱羧的发展方向, 具有广阔的应用前景。受到Pd催化脂肪酸脱羧的启发, Schouwer F D等[5]筛选了很多Pd和Pt催化剂用来对焦谷氨酸和谷氨酸脱羧。Claes L等[6]采用Ru(OH)x/γ -Al2O3催化剂, 分子氧作为氧化剂, 支链是脂肪链的氨基酸都可以被氧化脱羧生成腈。Verduyckt J等[7]使用Ru/C对L-赖氨酸脱羧, 选择性仅8%, 大多都生成L-赖氨醇等胺衍生物。Ru基催化剂由于其独特的电子结构, 适合对分子氢解离吸附而被广泛用于加氢以及还原胺化反应。
本文采用自制的Ru/TiO2催化剂对L-赖氨酸脱羧反应进行评价, 关联催化剂性质与脱羧反应性能的关系, 研究反应介质、pH、初始压力、反应时间和反应温度等对L-赖氨酸脱羧反应的影响, 为化学法实现L-赖氨酸脱羧制备戊二胺提供重要基础。
采用液相浸渍法制备钌基催化剂。将RuCl3溶解于去离子水或无水乙醇中, 使用超声分散(1~4) h, 加入TiO2(金红石型), 搅拌(6~24) h, 其中Ru元素为TiO2质量分数5%, 去离子水与TiO2质量比为1~10∶ 1; 然后将物料离心、洗涤和烘干, 空气氛围, 300 ℃焙烧4 h; 最后将焙烧后的物料置于H2气氛下, (300~600) ℃还原, 即得氨基酸脱羧催化剂Ru/TiO2。其中, 负载质量分数为5%, 金红石型TiO2作为载体, 300 ℃还原的催化剂记为5%Ru/TiO2-r-300, 未还原的催化剂记为5%Ru/TiO2-r-0, 纯载体记为TiO2-r。
采用荷兰Quanta 600FEG 型发射扫描电镜对催化剂样品进行形貌测定;
N2吸附-脱附在美国麦克仪器公司ASAP202 型分析仪上进行, 测定催化剂样品的比表面积及孔径分布和孔结构。
使用日本电子株式会社JEM-2100F场发射透射电子显微镜对催化剂进行高分辨率透射电镜分析, 确定催化剂精细形貌和晶粒尺寸。
由于游离的L-赖氨酸不稳定, 选用L-赖氨酸盐酸盐作为模板底物, 在间歇式高压搅拌反应釜内进行脱羧反应。操作步骤:在高压反应釜中加入一定量L-赖氨酸盐酸盐溶液和催化剂, 并根据反应条件, 加入磷酸调节pH。高压釜密封后, 用氮气进行置换6次, 随后通入氢气到达设定压力, 并开始程序升温, 到达预定时间, 完成反应过程, 自然冷却, 打开反应釜, 过滤催化剂得到澄清的反应溶液, 使用GC-MS对反应产物进行定性和定量分析。
L-赖氨酸在Ru/TiO2催化作用下, 首先发生脱羧反应生成1, 5-戊二胺。随着反应过程中H2的解离吸附生成大量活性H原子, 1, 5-戊二胺作为中间体, 在活性H的作用下继续发生脱氨和环合等一系列副反应, 生成正戊胺和六氢吡啶等副产物。
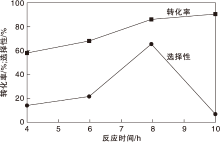
在磷酸与L-赖氨酸物质的量比2和初始压力4 MPa条件下, 不同反应时间对L-赖氨酸脱羧反应的影响如图1所示。
由图1可见, 反应时间小于8 h时, 随着反应时间增加, 转化率和选择性均增加。当反应时间过长, 如10 h, 1, 5-戊二胺选择性低于3%。因此对于Ru/TiO2催化体系, 最优反应时间为8 h。
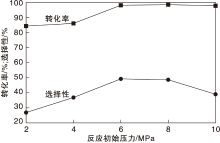
在固定反应时间6 h和磷酸与L-赖氨酸物质的量比2条件下, 不同初始压力对L-赖氨酸脱羧反应的影响如图2所示。
由图2可见, 初始压力小于6 MPa时, 随着初始压力增加, 选择性与转化率都随之增加, 当初始压力超过6 MPa, 继续增加反应压力, 转化率依旧保持99%以上, 而选择性开始下降。从热力学平衡观点来看, L-赖氨酸脱羧反应过程中消耗的氢气恒定。因此, 适宜的初始压力为6 MPa。
在反应时间6 h条件下, 不同磷酸量对L-赖氨酸脱羧反应的影响如图3所示。
由图3可见, 加入不同磷酸量对反应产物组成进行分析, 表明反应液的pH对该反应的选择性具有较大的影响。在不同初始压力条件下, 均具有相似的变化趋势。不加入磷酸或加入酸量较少时, L-赖氨酸盐酸盐的脱羧活性较低, 生成的胺选择性均小于10%。继续增加酸量, 生成的胺选择性增加。当磷酸与L-赖氨酸物质的量比为3时, 胺选择性最高。继续增加磷酸量, 磷酸与L-赖氨酸物质的量比为4时, 胺选择性降低。
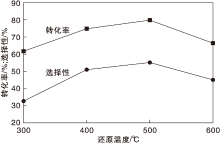
在反应时间6 h、磷酸与L-赖氨酸物质的量比3和初始压力6 MPa条件下, 不同还原温度对L-赖氨酸脱羧反应的影响如图4所示。
由图4可见, 当Ru/TiO2的还原温度为400 ℃和500 ℃时, 催化剂具有较高的反应活性。当催化剂还原温度为500 ℃时, 反应转化率达80%, 戊二胺选择性达52%。继续升高还原温度, 转化率和选择性均有所下降。因此, 适宜的还原温度为500 ℃。
不同还原温度下Ru/TiO2-r的比表面积、孔径和孔容如表1所示。
| 表1 不同还原温度下Ru/TiO2-r的比表面、孔径和孔容 Table 1 Specific surface areas, pore size and pore volumes of Ru/TiO2-r at different reduction temperature |
由表1可见, 负载前TiO2比表面积为25. 6 m2· g-1, 负载活性组分未还原前Ru/TiO2-r催化剂样品(以RuO2/TiO2-r形式存在)的比表面积为28.0 m2· g-1, 负载后比表面积增加。样品的比表面积随着还原温度的升高逐渐减小, 比表面积从29.4 m2· g-1(300 ℃还原)降至22.2 m2· g-1(600 ℃还原), 孔容变化不明显。金红石型TiO2为AB2型离子晶体结构, 属于四方晶系, 空间群为P4/mmm, 而RuO2也是属于金红石型晶体, 在催化剂制备过程中自发实现自组装, 出现外延生长现象。虽然TiO2比表面积较低[8], 但能够更好地促进Ru的分散, 在催化反应过程中, 能够对Ru活性组分起到稳定作用。
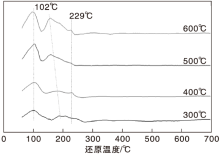
Zaera F[9]研究表明, 负载贵金属的催化剂加氢作用原理为:首先氢气吸附于金属原子, 再解离为原子形式, 为加氢脱羧反应提供活性氢物种, 因此吸脱附氢的性能是研究催化剂的重要因素。图5为不同还原温度催化剂的H2-TPD谱图。由图5可以看出, 样品在(50~500) ℃具有3个H2-TPD脱附峰, 分别出现在102 ℃、(150~200) ℃和229 ℃, 分别与活性组分Ru的氢气脱附能力相关联[10]。低温区域的峰是催化剂表面H2的弱吸附, 高温的2个峰分别与催化剂活性组分和载体表面对H2强吸附相关[11]。不同还原温度下的Ru/TiO2催化剂, 均在约102 ℃低温区域出现脱附峰, 即H的弱吸附作用不被还原过程改变。在(150~250) ℃高温区域的脱附峰由高低温两个峰叠加而成, 其中对于较低温度的峰是强吸附氢出峰, 并且随着还原温度的升高, 出峰温度降低, 表明H2在高温还原的催化剂样品表面更易于解离; 而较高温度的峰, 与氢溢流现象相关, 峰面积越大, 表明更多的氢被载体吸附分解[12]。由图5还可以看出, 随着还原温度升高, 600 ℃还原下的催化剂具有最强的氢溢流现象, H2对TiO2载体解离有很强的促进作用, 导致在脱羧反应中进一步发生脱氨和环合等副反应, 表现为戊二胺选择性降低。
不同还原温度催化剂的SEM照片如图6所示。由图6可以看出, Ru/TiO2催化剂样品的颗粒尺寸分布在(44.6~78.0) nm, 随着还原温度升高, 催化剂颗粒的粒径略有增大, 平均粒径分别为44.6 nm(300 ℃)、67.9 nm(400 ℃)、77.8 nm(500 ℃)和73.6 nm(600 ℃), 基本呈正态分布。
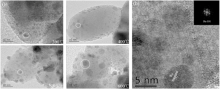
不同温度催化剂的HRTEM照片通过晶格栅标定后确定该团簇为被还原的金属Ru的(101)面[13], 如图7所示。由图7可见, 负载于载体上的金属Ru是单分散的球形纳米颗粒。还原过程后有团聚的大颗粒(白色圈内)生成, 颗粒粒径均匀, 约(3~4) nm, 且分散度较高。600 ℃还原时, 既有一大部分小晶粒Ru颗粒, 也有少量大尺寸的Ru聚集体(大于5 nm), 总体呈现大小颗粒并存的分散状态。Ru聚集体的存在不利于活性位点的分散作用, 降低了活性组分的利用率[14, 15]。在加氢脱羧反应中, 大颗粒的Ru聚集体会对脱氨副反应起催化作用, 导致在600 ℃还原温度下催化剂选择性降低, 这一点与图5中600 ℃还原温度下H2-TPD结果吻合。
在Ru/TiO2催化L-赖氨酸脱羧反应中, 还原温度是影响催化剂性能的关键因素。在(300~500) ℃提高反应温度, 比表面积和吸附氢的量均增加, 但是当反应温度继续升高, 由于还原温度升高, 催化剂发生烧结现象, 比表面积降低。结合催化剂评价结果, 最优的脱羧催化剂还原温度为500 ℃, 催化剂具有最大的比表面积、活性位点及最合适的氢吸附量。
整个反应体系的热力学平衡是反应温度和初始压力的函数, 当温度低于500 ℃, 转化率随着反应压力和温度的增加而升高。当反应压力低于6 MPa, 反应时间小于8 h时, 选择性和转化率随初始压力和反应时间增加而增加, 继续增加压力和反应时间, 选择性则降低。反应初始pH对L-赖氨酸脱羧形成正戊胺的选择性有明显影响, 在磷酸与L-赖氨酸物质的量比为3时, 有利于1, 5-戊二胺的生成。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|