作者简介:高明明,1990年生,男,陕西省西安市人,工程师,研究方向为连续催化及催化新材料。
采用共沉淀法制备CuZnAl复合催化剂,借助N2吸附-脱附、TG-DTA、XRD和H2-TPR对催化剂进行表征分析,在固定床反应器中考察反应条件对催化剂性能的影响以及在优选条件下的催化剂活性稳定性。结果表明,CuZnAl复合催化剂具有介孔特征,比表面积和孔径较大,前驱体经500 ℃活化,阴离子基团分解完全,晶体成型,热稳定性好,主活性组分以CuO和CuAl2O4尖晶石形式存在,250 ℃条件下经H2还原为活性相Cu0粒子。合成N-乙基哌嗪的适宜条件为:反应温度180 ℃,反应压力2.5 MPa,空速0.5 h-1,在此条件下连续运行32 d,哌嗪转化率大于85%,N-乙基哌嗪选择性大于95%。
CnZnAl catalyst was prepared by co-precipitation method,and characterized by N2 adsorption,TG-DTA,XRD and H2-TPR.Reaction conditions and stability of catalyst were evaluated in a fixed-bed reactor.The results showed that the catalyst had mesoporous characteristics and high specific surface area,as well as a large pore diameter.After catalyst precursor was activated at 500 ℃,anionic groups decomposed completely and crystal was formed to possess good thermal stability.The main active components existed in the form of CuO and CuAl2O4 spinel,which were reduced to active phase Cu0 particles by H2 at 250 ℃.Under optimized reaction conditions which were reaction temperature 180 ℃,reaction pressure 2.5 MPa and space velocity 0.5 h-1,conversion of piperazine and selectivity to N-ethylpiperazine reached above 85% and 95%,respectively after 32 d of reaction.
N-乙基哌嗪作为医药中间体及精细化学品在制药及有机合成中获得广泛应用, 主要用于合成蒽氟沙星、磷酸二酯酶抑制剂、人体杀虫抗生剂等, 在橡胶和塑料等高分子领域也大量应用。合成N-乙基哌嗪的方法主要有两种:一是以哌嗪为原料, 与烷基化剂如卤代烷、乙腈、脂、醇和醛等进行烷基化反应, 此法操作复杂, 稳定性差, 三废多; 二是以二乙醇胺为原料, 在NH3和H2气氛下合成, 该法后处理复杂, 三废多, 分离难度大[1, 2, 3, 4, 5]。
目前, 以哌嗪为原料与乙醇催化合成N-乙基哌嗪的方法, 具有过程简单, 三废少, 逐渐成为研究热点, 反应工艺主要包括釜式和固定床两种[6]。文献[1, 4, 7]以哌嗪为原料, 与乙醇催化合成N-乙基哌嗪, 反应装置均为固定床反应器, 但文献[1]为间歇式操作; 文献[4]以Cu/γ -Al2O3为催化剂, 哌嗪转化率74.94%, N-乙基哌嗪选择性43.75%, 副产物三乙烯二胺转化率较高达34.82%; 文献[7]以CuZnAl为催化剂, 固定床连续化反应, 哌嗪转化率较高为96.9%, N-乙基哌嗪选择性为85.1%。
本文对自制CuZnAl复合催化剂进行表征分析, 以哌嗪和乙醇为原料, 在固定床反应器中经催化剂连续催化合成N-乙基哌嗪, 并对反应条件进行优化, 验证催化剂的稳定性能。
采用共沉淀法制备催化剂, 配制铜锌铝硝酸盐混合溶液, 并将硝酸盐溶液倒入搅拌釜内, 温度恒定后, 连续搅拌下将一定浓度碱溶液逐滴加入釜内, 滴加至溶液pH> 8, 釜内继续搅拌陈化, 过滤, 洗涤, 干燥, 焙烧活化, 压片成型, H2还原后即得CuZnAl复合催化剂。
在美国麦克仪器公司ASAP2010型物理吸附仪上测定催化剂的比表面积、孔容和孔径分布。
在德国布鲁克公司D8 Advance型的X射线衍射仪上测定催化剂的物相结构。操作条件:N2气氛, CuKα , 工作电压40 kV, 工作电流10 mA, 步幅0.02° , 扫描范围10° ~80° 。
H2-TPR在北京北分天普仪器技术有限公司TP-5000型装置上进行, 以5%H2-95%N2为还原气, 升温速率为5 ℃· min-1, 检测温度为(50~600) ℃。
在TG-DTA92型热分析仪上测定催化剂热稳定性, 升温速率10 ℃· min-1, 检测温度为(30~800) ℃。
NH3-TPD在北京北分天普仪器技术有限公司TP-5000型吸附仪上进行, 样品先用氦气进行高温预处理, 然后降温至50 ℃进行脉冲NH3吸附饱和, 氦气吹扫后, 程序升温采集NH3脱附曲线。
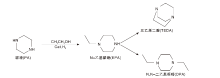
N-乙基哌嗪合成反应路径如图1所示。哌嗪中氨基与乙醇羟基发生脱水反应生成目标产物N-乙基哌嗪, N-乙基哌嗪上另外一个氨基可以进一步与醇羟基发生脱水反应生成副产物N, N-二乙基哌嗪, 也可以发生自缩合反应生成三乙烯二胺。N-乙基哌嗪合成反应在固定床反应器中进行, 反应管恒温段装填CuZnAl复合催化剂, 催化剂经活化后, 连续从反应管顶部通入原料和氢气, 原料经催化剂床层进行反应, 反应液进入气液分离罐进行分离。反应产物采用日本岛津公司GC-2014气相色谱分析仪定量分析。
2.1.1 N2吸附-脱附
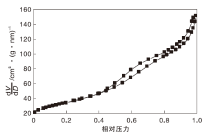
CuZnAl复合催化剂的N2吸附-脱附等温线如图2所示。
由图2可以看出, N2吸附-脱附等温线具有滞后环, 为Ⅳ 等温线, 具有介孔特征。在相对压力0~0.45低压阶段, N2吸附量缓慢增加, N2以单分子层吸附在催化剂内表面, 存在一定微孔结构。当相对压力> 0.45时, 吸附量增加迅速, 发生多分子层吸附, 由于催化剂介孔结构的存在, 孔道中发生毛细凝聚现象, 有明显的回滞环。采用BET及BJH方程计算得到CuZnAl复合催化剂比表面积及孔容分别为124.117 m2· g-1和0.234 cm3· g-1, 平均孔径为7.542 nm。催化剂孔径大, 生成的N-乙基哌嗪能够及时脱附, 选择性提高。
2.1.2 TG-DTA
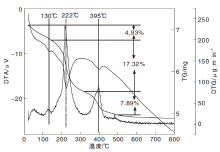
CuZnAl复合催化剂的热重谱图如图3所示。
由图3可知, CuZnAl复合催化剂有4个失重阶段, 第一阶段在142 ℃之前, 失重率为4.93%, DTG中最大失重峰温度为130 ℃, DTA为吸热峰, 对应催化剂前驱体吸附水、部分结晶水、OH-1和少部分NO3-的脱除; 第二阶段在320 ℃之前, 失重率为17.32%, DTG中最大失重温度为222 ℃, DTG为较大的吸热峰, 对应催化剂中剩余结晶水、多数NO3-、CO32-及有机物的分解; 第三阶段在500 ℃之前, 失重率为7.89%, DTG中最大失重峰温度为395 ℃, DTA为吸热峰, 对应催化剂中剩余NO3-和CO32-的分解, 另外DTA吸热峰峰形较宽, 表明催化剂内部晶相结构趋于完成。(500~800) ℃, 催化剂基本未失重, 也无吸热峰或放热峰出现, 结构稳定。
2.1.3 XRD
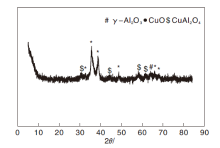
CuZnAl复合催化剂的XRD图如图4所示。
由图4可知, CuZnAl复合催化剂在35.6° 、38.8° 出现较大的CuO特征衍射峰, 同时存在较小的CuAl2O4尖晶石衍射峰, 晶体结构缺陷较大。图中未出现ZnO衍射峰, 表明ZnO在催化剂中分散均匀, 以微晶形式存在。
2.1.4 H2-TPR
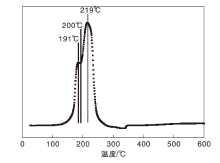
CuZnAl复合催化剂的H2-TPR谱图如图5所示。
由图5可知, CuZnAl复合催化剂分别在191 ℃和219 ℃出现H2消耗峰。在200 ℃之前, H2还原特征峰归属于催化剂表面游离CuO物种的还原; 200 ℃以后, H2还原特征峰归属于催化剂孔隙中CuO组分及合金晶体中Cu物种的还原(Cu0), 250 ℃条件下Cu物种经H2还原为活性相Cu0粒子。
以哌嗪转化率(XPA)、N-乙基哌嗪选择性(SEPA)、N, N-二乙基哌嗪选择性(SDPA)、三乙烯二胺选择性(STEDA)为评价指标, 考察反应温度、反应压力和空速对反应结果的影响。
2.2.1 反应温度
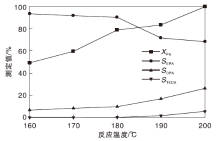
反应温度对CuZnAl复合催化剂性能的影响如图6所示。
由图6可以看出, 哌嗪转化率、N, N-二乙基哌嗪以及三乙烯二胺选择性均随反应温度的升高而增加, 反应温度200 ℃, 哌嗪转化率约100%, 高温对哌嗪转化有利; N, N-二乙基哌嗪选择性随反应温度升高先小幅度增加后迅速上升, 由180 ℃的9.68%增加为190 ℃时的26.84%; 三乙烯二胺选择性在反应温度低于180 ℃时为零, 超过180 ℃后逐渐增加; N-乙基哌嗪选择性随反应温度升高先小幅度减小后迅速下降, 之后又趋于平稳, 由180 ℃的90.2%下降为190 ℃时的71.6%, 降幅较大, 对反应不利。综合考虑, 选择最佳反应温度为180 ℃。
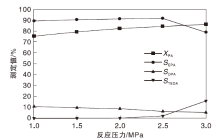
2.2.2 反应压力
反应压力对CuZnAl复合催化剂性能的影响如图7所示。由图7可知, 随着反应压力升高, 哌嗪转化率缓慢增加, N-乙基哌嗪选择性在反应压力小于2.5 MPa时变化较小, 当反应压力为3 MPa时, N-乙基哌嗪选择性减小明显; 相反的, 三乙烯二胺选择性增加显著, N, N-二乙基哌嗪选择性随反应压力增加有降低趋势, 表明反应压力过高, 利于副产物三乙烯二胺生成。综合考虑, 选择最佳反应压力为2.5 MPa。
2.2.3 空速
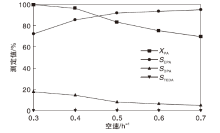
空速对CuZnAl复合催化剂催化性能的影响如图8所示。
由图8可以看出, 随着空速增加, 哌嗪转化率和N, N-二乙基哌嗪选择性呈下降趋势, N-乙基哌嗪选择性先增加后趋于平缓, 主要原因是, 空速增大, 原料在催化剂床层停留时间缩短, N-乙基哌嗪到N, N-二乙基哌嗪反应减少, 继续增加空速, 原料反应不完全。在考察的空速范围, 无副产物三乙烯二胺生成。综合考虑, 选择最佳反应空速为0.5 h-1。
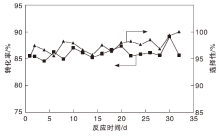
2.2.4 催化剂活性稳定性
在反应温度180 ℃、反应压力2.5 MPa、空速0.5 h-1条件下, CuZnAl复合催化剂活性稳定性评价结果如图9所示。由图9可知, 催化剂性能稳定, 连续运行32 d, 哌嗪转化率大于85%, N-乙基哌嗪选择性大于95%。
(1) 制备的CuZnAl复合催化剂具有介孔特征, 比表面积以及孔容分别为124.117 m2· g-1和0.234 cm2· g-1, 平均孔径为7.542 nm。孔径较大, 前驱体经500 ℃焙烧活化, 阴离子分解完全, 晶型形成, 热稳定性好, 催化剂中主活性组分以CuO和CuAl2O4尖晶石形式存在, 且在250 ℃条件下, 经H2还原为活性相Cu0粒子。
(2) 反应温度对催化剂催化活性影响较大, 高温对哌嗪转化有利, 但N, N-二乙基哌嗪以及三乙烯二胺选择性同样随反应温度升高而增加, N-乙基哌嗪选择性随反应温度升高先小幅度减小后迅速下降, 最佳反应温度为180 ℃; 反应压力小于2.5 MPa, N-乙基哌嗪选择性变化较小, 当反应压力为3 MPa, N-乙基哌嗪选择性减小明显, 三乙烯二胺选择性增加显著, N, N-二乙基哌嗪选择性随反应压力增加有降低趋势, 表明反应压力过高, 利于副产物三乙烯二胺生成, 最佳反应压力为2.5 MPa; 空速增加, 哌嗪转化率和N, N-二乙基哌嗪选择性呈下降趋势, N-乙基哌嗪选择性先增加后趋于平缓, 空速增大, 原料在催化剂床层停留时间缩短, N-乙基哌嗪到N, N-二乙基哌嗪反应减少, 继续增加空速, 原料反应不完全, 最佳反应空速为0.5 h-1。
(3) 在反应温度180 ℃、反应压力2.5 MPa、空速0.5 h-1条件下连续反应32 d, 哌嗪转化率大于85%, N-乙基哌嗪大于95%。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|