作者简介:焦玉荣,吉林省长春市人,博士,主要从事功能材料的制备、表征和应用。
以钛酸丁酯为钛源,MoS2为负载剂,通过溶胶-凝胶法和水热法制备TiO2/MoS2复合光催化剂。通过FT-IR、XRD、DRS、SEM、ERS和N2吸附-脱附等对催化剂组成、形貌及结构进行分析,并且以降解率为评价指标通过光催化甲基橙有机污染物来评价其催化活性。对负载量、复合催化剂用量和pH等进行优化研究。研究发现,TiO2/MoS2复合催化剂稳定性高、催化活性强。0.50 g TiO2/MoS2复合催化剂常温矿化降解50 mL的5 mg·L-1甲基橙溶液的降解率达97.53%。此外,复合材料催化降解甲基橙溶液这一过程符合一级反应动力学L-H方程。
TiO2/MoS2 composite photocatalysts were prepared by sol-gel and hydrothermal synthesis method,using TBOT as titanium source and MoS2 as carrier.Composition,morphology and structure of the catalysts were characterized using FT-IR,XRD,DRS,SEM,EDS and N2 adsorption-desorption. Their photocatalytic activity was tested by degradation of methyl orange (MO) pollutant. Loadings,dosage of composite catalyst and pH were optimized. TiO2/MoS2exhibited high stability and activity,with degradation of 97.53% attainable for 50 mL 5 mg·L-1 MO by 0.50 g of the composite catalyst at room temperature. Degradation of MO by TiO2/MoS2obeys first-order L-H kinetic model.
工业废水的处理一向是国内外废水处理的一大难题, 特别是能源范围, 工业废水的处理对我们生存环境造成了巨大的威胁。光催化技术在环境污染控制领域具有广阔的应用前景, 引起广泛关注, 并已成为研究热点之一。在许多光催化剂中, TiO2以其优异的催化性能、稳定的化学性能、安全性和较长的使用寿命而被广泛使用[1, 2, 3, 4, 5]。但是, 太阳能利用率低和易于重组的光生电子空穴限制了其光催化活性。为了提高半导体催化剂的光催化活性, 目前主要方法是对现有催化剂的结构和组成进行改性, 如对催化剂的晶相结构和缺陷的控制、调节能带位置、降低晶粒尺寸、半导体复合制备中孔结构光催化剂。文献[6, 7, 8, 9]通过负载在MoS2载体上来改性TiO2。
MoS2作为与TiO2电子结构和能带结构相匹配的二维结构窄禁带半导体, 通过控制其尺寸负载TiO2提高光生电子空穴的分离效率, 使更多的光生电子参与光催化反应, 提高半导体氧化还原能力, 从而提高光催化反应矿化效率[10, 11, 12, 13, 14]。通过催化矿化甲基橙(MO)有机溶液来评价催化性能[15, 16]。
本文以钛酸丁酯为前躯体, 层状MoS2为载体, 采用溶胶-凝胶和水热法制备TiO2/MoS2复合催化剂, 并以降解率为评价指标通过光催化甲基橙有机污染物来评价其催化活性。
钼酸铵, 分析纯, 金堆城钼业科技有限责任公司; 硫脲, 分析纯, 天津滨海科迪化学试剂有限公司; 钛酸丁酯、异丙醇、丙酮、无水乙醇和甲基橙, 分析纯, 天津科密欧化学试剂有限公司; 蒸馏水应用到整个实验过程中。
TiO2、MoS2和TiO2/MoS2制备参照文献[17]。将2.0 g钼酸铵和4.0 g硫脲加入30.0 mL水中, 在180 ℃高压反应釜中加热24 h, 清洗, 干燥后得黑色二硫化钼。将上述一定量产物加入30.0 mL乙醇中, 超声分散后将7.0 mL钛酸丁酯滴加进去, 搅拌均匀, 将混合液体转入高压反应釜中, 加热, 冷却, 洗涤后烘干, 得到黑灰色产物TiO2/MoS2。
按照上述方法, MoS2加入量分别为0.100 g、0.400 g、1.600 g和2.400 g制备的TiO2/MoS2分别记作TiO2/M1、TiO2/M2、TiO2/M3和TiO2/M4。
采用德国Bruker的 D8 ANVANCE型多晶X衍射仪表征晶相结构, Cu靶, 扫描范围10° ~70° 。
采用X-ray能量色散谱的场发射扫描电子显微镜Zeiss σ 300对样品形貌和组成进行测试。
采用美国Thermo fisher公司的6700型原位红外光谱仪对材料的组成进行分析。
采用北京科伟永兴仪器有限公司的UV-2600紫外漫反射对制得的复合材料进行禁带宽度分析。
采用北京金埃普公司的TP2800型物理吸附仪进行比表面积和微介孔性能分析。
将0.050 g材料加入50.0 mL甲基橙溶液中, 在光化学反应仪中搅拌30 min后打开氙灯进行光催化反应, 每15 min后取4.0 mL液体, 离心、过滤后取溶液上清液在464 nm处测定吸光度值, 用公式(1)计算降解率。
式中, DR为降解率, c0和ct分别为甲基橙溶液降解前后浓度, mg· L-1。
实验如下: (1) 将0.050 g的TiO2、MoS2、TiO2/M1、TiO2/M1、TiO2/M2、TiO2/M3和TiO2/M4七种催化材料分别加入50.0 mL的5 mg· L-1甲基橙溶液中进行光催化; (2) 分别取0.010 g、0.030 g、0.050 g和0.070 g的TiO2/MoS2复合材料加入50.0 mL的5 mg· L-1甲基橙溶液中进行光催化; (3) 将0.050 g TiO2/MoS2复合材料分别加入pH为2、7和10的50.0 mL的5 mg· L-1甲基橙溶液中进行光催化实验; (4) 将0.050 gTiO2/MoS2复合材料循环矿化降解50.0 mL的5 mg· L-1甲基橙溶液。
实验过程中的动力学行为以Langmuir-Hinshelwood(L-H)方程进行分析:
式中, c0和ct分别为甲基橙溶液降解前后浓度, mg· L-1, k为表面反应速率常数, mg· (L· min)-1, t为反应时间, min。
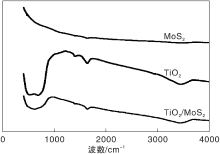
图1为MoS2、TiO2和TiO2/MoS2的FT-IR谱图。
由图1可以看出, TiO2在680 cm-1、1 340 cm-1、1 624 cm-1和3 429 cm-1处分别出现Ti— O键的伸缩峰、Ti— OH弱特征吸收峰、O— H的弯曲和伸缩振动峰; MoS2在1 639 cm-1处出现了特征吸收峰; TiO2/MoS2复合材料的峰包括TiO2、MoS2的特征吸收峰和O— H的伸缩振动峰。
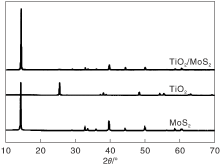
图2 为MoS2、TiO2和TiO2/MoS2的XRD图。由图2可以看出, TiO2在2θ 为25.74° 、38.11° 、47.81° 、55.91° 和63.19° 分别出现(101)、(112)、(200)、(211)和(204)晶面的衍射峰; MoS2在2θ 为14.74° 、32.93° 、39.85° 、50.10° 和60.41° 分别出现(002)、(102)、(103)、(110)和(008)晶面的衍射峰; TiO2/MoS2在14.74° 出现了(002)晶面MoS2衍射峰, 27.04° 出现了TiO2晶相(101)晶面衍射峰。TiO2在38.11° 、47.81° 、55.91° 和63.19° 的衍射峰因为加入MoS2而被弱化。
图3是TiO2、MoS2和TiO2/MoS2的SEM照片。
由图3可以看出, TiO2的形貌呈均匀颗粒球形状; MoS2是片层状形貌, 层与层之间的间隙保证了MoS2有较大的比表面积以及更多的反应点和反应边缘, 满足了对MoS2纳米材料性能的需求; TiO2/MoS2的TiO2颗粒均匀分布在MoS2片层表面, 表明TiO2已经负载到MoS2上。表面元素分析进一步证实负载情况。
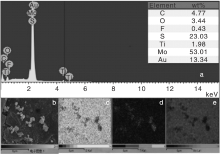
图4是TiO2/MoS2的EDS和面扫描。由图4可以看出, 催化剂表面上存在Ti、O、S和Mo四种主要元素。Ti元素含量较少, 可能是因为少量掺杂的原因, 但也表明TiO2成功地负载于MoS2上。
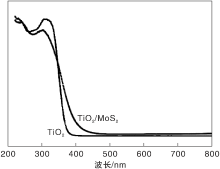
图5为TiO2、MoS2和TiO2/MoS2的DRS谱图。
由图5可以看出, TiO2/MoS2相对于TiO2出现了红移现象, 沿着光谱最陡的地方做切线与基线在x轴长波方向的交点为λ onset, 根据公式Eg=1 240/λ onse, 计算出TiO2和TiO2/MoS2的能隙是2.98 eV和2.53 eV, TiO2/MoS2的能隙减低对光的利用率增强, 提高了催化活性。
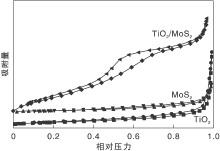
MoS2、TiO2和TiO2/MoS2的N2吸附-脱附等温曲线如图6所示。
 | 图6 TiO2、MoS2和TiO2/MoS2的N2吸附-脱附等温曲线Figure 6 Nitrogen adsorption-desorption isotherms of TiO2, MoS2 and TiO2/MoS2 |
由图6可知, TiO2/MoS2比表面积为51.48 m2· g-1, 高于TiO2比表面积5.29 m2· g-1的五倍多, 这是因为TiO2在MoS2表面积聚, 形成了一些新的空隙或微凸起, 使TiO2的团聚减少且均匀分布。相对于单一的MoS2和TiO2, 负载TiO2/MoS2孔分布较宽, 能够提供更多的表面活性中心来吸附有机污染物, 提高光催化降解效率。
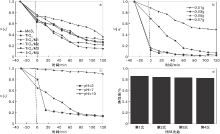
为了考察TiO2/MoS2光催化活性, 在光协同作用下常温矿化催化甲基橙, 分别考察负载量、催化剂用量和pH对催化剂催化活性的影响, 如图7所示。
图7a为相同质量的TiO2、MoS2、TiO2/M1、TiO2/M1、TiO2/M2、TiO2/M3和TiO2/M4七种不同的催化剂降解5 mg· L-1的50.0 mL甲基橙有机污染物的降解效果图, 可以看出, 1.600 g负载量的TiO2/MoS2催化剂的性能明显优于其他光催化剂, 因为适量的MoS2增大了催化剂的活性点。图7b为复合催化剂用剂量对催化矿化甲基橙的效果图, 当质量增加0.05 g时, 降解能力保持不变, 因为过量的催化剂对光的屏蔽作用, 反而影响催化效率。图7c为pH对催化效果的影响, 碱性环境中催化剂的催化活性低于酸性和中性溶液, 是因为酸性条件下, 催化剂能够在溶液中有良好的分散性, 有利于染料分子在催化剂表面的吸附和扩散[15], 此外, 也有利与催化剂表面电子的转移, 提高电子-空穴对的分离效率。图7d为催化剂的再生能力, 表明复合催化剂对光有较好的稳定性。
降解5 mg· L-1甲基橙溶液的动力学参数如表1所示, TiO2、MoS2和TiO2/MoS2催化矿化甲基橙溶液的L-H准一级动力学拟合结果如图8所示。
| 表1 降解5 mg· L-1甲基橙溶液的动力学参数 Table 1 Pseudo-first-order kinetic parameters for MO degradation |
由图8结合表1可以看出, TiO2/MoS2催化活性优于单一的TiO2和MoS2。因为TiO2分布在层状MoS2表面, 使催化剂和甲基橙有更多反应点和反应边缘, 提高催化效率。
采用溶胶-凝胶和水热法制备二氧化钛与二硫化钼复合纳米材料, 并且将其应用于光降解甲基橙溶液实验中, 考察负载量、催化剂用量和pH等因素对催化效果的影响, 结果表明, 复合材料比单一的二氧化钛具有良好的光学活性和较高的光利用率, 催化降解过程符合一级动力学模型。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|