作者简介:孙晨,1990年生,女,山东省淄博市人,工程师,主要研究方向为工业催化。
采用共沉淀法制备Cu-Zn-Al-Mg甲醇合成催化剂,并用XRD、N2低温吸附、H2-TPR、SEM、TG-DTG等手段对催化剂进行表征,着重考察焙烧温度对催化剂结构与性能的影响。结果表明,随着焙烧温度的增加,铜锌间的相互作用增强,有利于催化反应进行;但过高的焙烧温度又会导致催化剂中CuO晶粒过大,不利于铜的分散。350 ℃下焙烧4 h得到的催化剂活性最好;300 ℃下适当延长焙烧时间得到的催化剂无法达到相同性能水平。
Cu-Zn-Al-Mg catalyst for methanol synthesis was prepared by coprecipitation method.Study was focused on the effects of calcination temperature on the structure and catalytic performance of the catalyst.XRD,N2-physisorption,H2-TPR,SEM,TG-DTG were used to characterize the physico-chemical properties of the catalysts,and catalysts activity were evaluated in a micro-reactor.Results indicated that suitable calcination temperature could promote the catalytic performance.Higher calcination temperature was beneficial to the catalytic reaction by enhancing the interaction between CuO and ZnO.However,catalysts with excessively high calcination temperature tended to form oversized CuO particles,which was not conducive to copper dispersion.The catalyst calcined at 350 ℃ presented the best activity,while catalyst calcined at 300℃ could not achieve similar activity with increase calcination time.
我国的资源结构长期处于“ 富煤、缺油、少气” , 因此我国化石能源大幅偏重于煤炭, 但煤炭直接燃烧会带来环境影响, 如何清洁高效利用引起广泛关注。甲醇是一种重要的石油化工原料, 可用于制造甲醛、醋酸、甲胺、甲酸甲酯等有机产品[1, 2, 3]。另外, 甲醇还是一种性能优良的清洁燃料, 可单独或者与汽油混合作为汽车燃料。因此, 利用煤炭气化生产甲醇是一条优良的技术路线, 具有广阔的市场[4, 5]。
甲醇合成催化剂是该甲醇生产技术路线的关键技术。Cu-Zn-Al催化剂由于具有良好的低温活性与高温稳定性而成为目前研究最多的合成甲醇催化剂体系[6]。其中, Cu为主要活性组分[7], ZnO的加入可以与CuO产生协同效应, 提高催化剂活性。Al2O3作为载体, 可以提高催化剂的比表面积和铜的分散度, 防止反应过程中因铜晶粒烧结导致催化剂失活, 提高催化剂的稳定性[8, 9]。还有研究[10]表明在Cu-Zn-Al体系催化剂中加入适量MgO, 更利于铜晶粒的分散, 可以进一步提高催化剂的热稳定性。
研究[11]表明, 焙烧温度对催化剂的物化结构及性质影响显著。适宜的前驱体焙烧温度可以提高 Cu 的分散性, 增大 Cu 的比表面积, 从而提高催化剂的活性[12]。对于Cu-Zn-Al催化剂, 随着焙烧温度的升高, CuO结晶度越来越好, 但焙烧温度过高, 铜锌组分间残留的高温碳酸盐会被提前分解, 不利于催化过程; 而焙烧温度过低, 则会导致CuO结晶度较差, 同样不利于后续催化过程[13]。但对于Cu-Zn-Al-Mg甲醇合成催化剂, 焙烧温度对其催化性能的影响鲜有报道。本文采用共沉淀法制备Cu-Zn-Al-Mg甲醇合成催化剂前驱体, 分别在300 ℃、350 ℃和400 ℃下焙烧4 h, 利用XRD、N2低温吸附、H2-TPR、SEM、TG-DTG等表征手段, 详细研究不同焙烧温度对催化剂结构与性能的影响, 并通过设置300 ℃、6 h焙烧对比试验, 来验证低温下仅通过延长焙烧时间能否达到高温焙烧效果。
配制浓度为1 mol· L-1的Zn、Al混合硝酸盐溶液, 记为溶液A; 配制浓度为1 mol· L-1的Cu、Zn、Mg混合硝酸盐溶液, 记为溶液B, 其中Cu、Zn、Al、Mg的总物质的量比为16:6:4:1。配制浓度为1 mol· L-1的Na2CO3溶液, 记为溶液C。将预热后的溶液A与溶液C按一定速率并流加入适量底水中, 不断搅拌, 反应过程中控制pH值在7.0~7.5。溶液A滴定完成后, 继续向沉淀中并流加入预热后的溶液B 与溶液C, 不断搅拌, 反应过程中控制pH值在7.0~7.5。将沉淀老化2 h后过滤洗涤, 110 ℃下干燥8 h。取干燥料分别按300 ℃& 4 h, 350 ℃& 4 h, 400 ℃& 4 h和300 ℃& 6 h进行焙烧, 加入成型助剂成型, 依次标记为催化剂Cat-300-4、Cat-350-4、Cat-400-4和Cat-300-6。
利用Bruker公司的D8型X射线衍射仪对样品进行物相分析, 采用Cu Kα 射线源, 工作电压40 kV, 工作电流40 mA, 扫描速度10° · min-1, 步长0.02, 扫描范围2θ =10° ~80° 。
利用美国麦克仪器公司2020物理吸附仪测定样品织构性能, 以N2为吸附质。称取0.2000 g样品并装填入管中, 先在300 ℃下抽真空预处理7 h脱附表面吸附的杂质, 再于-196 ℃下测定吸附-脱附曲线。样品的比表面积采用BET方法在相对压力0.05~0.20之间计算得到。孔容根据N2在相对压力为0.98 时的吸附量确定。孔径分布曲线采用吸附分支通过BJH方法确定, 孔径分布曲线最高点对应的孔径作为最可几孔径。
利用美国麦克仪器公司2920进行H2-程序升温还原, 测试样品的还原性能。称取50 mg样品于20 mL· min-1的Ar下升温至200 ℃保持1 h, 待样品冷却至室温, 切换为20 mL· min-1的还原气(10%H2-Ar), 以5 ℃· min-1的升温速度进行程序升温, TCD检测。
利用日本日立公司s-4800场发射扫描电镜表征催化剂前驱体的形貌。将样品均匀涂覆在导电胶上, 并用洗耳球吹掉多余的催化剂粉末, 然后将样品放入样品室分析。
利用梅特勒-托利多TGA/DSC 3+型同步热分析仪进行同步热分析测试。称取30 mg样品, 以10 K· min-1的速率由50 ℃升温至150℃, 保温30 min, 继续以10 K· min-1的速率由150 ℃升温至800 ℃, 测量过程中样品质量变化。
催化剂活性评价在固定床连续流动反应装置上进行。每次测试选取(20~50)目的催化剂2 mL, 用2 mL等粒度瓷环稀释。在体积分数为5%H2-95%N2 气氛下进行升温还原, 4 h内由室温升温至170 ℃并恒温2 h, 再用2 h升温至220 ℃继续恒温2 h。还原完毕后切换为原料气(体积组成: CO=13%~14%, CO2=4%~5%, N2=10%, 剩余为H2), 在(235~245) ℃、5.0 MPa和10 000 h-1条件下, 测定CO转化率和甲醇时空产率; 待数据稳定后, 在原料气气氛下降压至0.1 MPa, 升温至400 ℃, 空速降为3 000 h-1, 老化10 h后降温至(235~245) ℃, 测定老化后的CO转化率和甲醇时空产率。采用Agilent 7890A气相色谱在线分析尾气组成。整个分析流程有三个并联的分析单元: 分析C1-C6烃类, 配制一根HP-PLOT“ S” Al2O3柱子和一个FID检测器; 分析CO、CO2、N2, 配制一根5A分子筛柱, 两根ProPackQ柱和一个TCD检测器; 分析H2的检测器, 配制一根5A分子筛柱, 一根ProPackQ柱和一个TCD检测器。
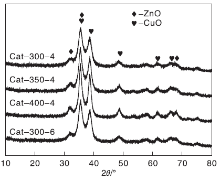
图1为不同焙烧温度下制备的催化剂XRD图。
从图1可以看出, 所有催化剂的XRD衍射图谱出峰位基本一致。2θ =35.6o、38.7o、48.4o、61.7o和66.1o等处出现CuO特征衍射峰, 2θ =32.1o、35.6o和68.1o等处出现ZnO特征衍射峰。没有检测到Al2O3和MgO的特征衍射峰, 说明上述催化剂样品中的Al2O3和MgO以无定型或微晶状态存在, 分散性较好[14, 15]。从图1中还可以看出, 随着焙烧温度的升高, CuO衍射峰逐渐变得尖锐, 400 ℃& 4 h焙烧得到的催化剂样品CuO结晶度最高, 分散性最差。300 ℃& 6 h焙烧样品的XRD图与300 ℃& 4 h焙烧的较为相似, CuO结晶度明显较350 ℃& 4 h焙烧的低。表1为利用谢乐公式计算的CuO晶粒大小, 结果同样显示焙烧温度的升高会导致CuO晶粒变大, 不利于Cu的分散。300 ℃& 6 h焙烧得到的催化剂样品CuO晶粒尺寸与300 ℃& 4 h焙烧样品更为接近, 明显较350 ℃& 4 h焙烧样品的小。
| 表1 催化剂的CuO晶粒大小 Table 1 CuO diameter of catalysts |
表2列出了不同催化剂利用N2低温吸附-脱附进行织构性质表征的结果。
| 表2 催化剂的织构性质 Table 2 Textural properties of catalysts |
由表2可见, 随着焙烧温度增加, 催化剂比表面积和孔容逐渐减小, 平均孔径逐渐增大。300 ℃& 6 h焙烧得到的催化剂样品织构性质与300 ℃& 4 h焙烧的催化剂较为相似, 与350 ℃& 4 h焙烧的相差较大, 说明延长焙烧时间对催化剂织构性能的影响较提高焙烧温度要小。
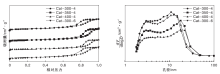
图2为不同催化剂的N2吸附-脱附等温曲线及孔径分布图。由图2可以看出, 催化剂样品的N2吸附-脱附等温曲线均属于Ⅳ 型, 在相对压力大于0.7后出现了明显滞后环, 说明催化剂具有介孔结构[16]。且随焙烧温度的升高, 滞后环闭合的压力增大, 这表明过高的焙烧温度会导致催化剂中的微孔结构遭到破坏, 致使催化剂比表面积下降, 孔容减小。催化剂样品孔径在(2~100) nm间呈双峰分布, 且随着焙烧温度的增加, 催化剂小孔变少, 最可几孔径变大。焙烧温度为400 ℃时, 这一现象尤其明显。而300 ℃& 6 h焙烧得到的催化剂样品N2吸附-脱附等温曲线与孔径分布均与300℃& 4 h焙烧的催化剂十分相似, 同样可以说明延长焙烧时间对催化剂织构性能的影响相对较小, 与表2数据规律一致。
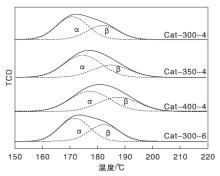
图3为不同焙烧温度下制备的催化剂H2-TPR谱图和高斯拟合图, 其高斯拟合数据见表3。
| 表3 催化剂的H2-TPR高斯拟合分析数据 Table 3 Gaussian fitting analysis of the H2-TPR profiles |
从图3可以看出, 在(150~220)℃之间, 上述催化剂样品的TPR曲线呈现出一个宽的还原峰并伴随着一个肩峰。由于ZnO和Al2O3在此温度范围内不能被还原, 因此低温还原峰(α 峰)与表面 CuO以及与 ZnO 发生强相互作用的高分散 CuO 颗粒有关, 高温还原峰(β 峰)与体相 CuO 颗粒有关[17]。
由表3可以看出, 随着焙烧温度的降低, 低温还原峰(α 峰)逐渐向低温方向移动, 说明CuO的分散度越来越好, CuO晶粒尺寸越来越小, 与XRD结果相一致。同时, 高温还原峰(β 峰)也随着焙烧温度的降低逐渐向低温方向移动, 这说明体相铜的还原也变得越来越容易, 催化剂的烧结程度低[18]。由表3还可以看出, 350 ℃下焙烧得到的催化剂较300 ℃和400 ℃下焙烧的催化剂α 峰占总还原峰比例大, 说明350 ℃下焙烧得到的催化剂表面铜含量高, 有更多的活性位暴露于催化剂表面, 导致其催化剂活性提高, 催化剂活性测试结果也显示350 ℃& 4 h焙烧得到的催化剂活性最好。300 ℃下焙烧6 h得到的催化剂的H2-TPR曲线与焙烧4 h的十分相似, 说明300 ℃& 6 h焙烧的催化剂与300 ℃& 4 h焙烧的催化剂具有相似的还原行为。
图4为催化剂成型前焙烧粉料的TG和DTG曲线。TG曲线显示, 在(50~800)℃之间, 焙烧粉料随温度递增呈阶段性失重。且焙烧温度越高、焙烧时间越长, 焙烧粉料失重率越小。从DTG曲线可以看出, 在(50~800)℃之间, 焙烧粉料的失重大致分为三个阶段。在150 ℃之前的失重, 主要对应于焙烧粉料表面吸附的杂质和水; (150~400)℃之间是前驱体焙烧后残留的碳酸盐分解引起的失重, 焙烧温度越高、焙烧时间越长, 残留的碳酸盐越少; (400~650)℃之间, 则是由于前驱体焙烧残留的高温碳酸盐分解导致的失重。催化剂前驱体中的碳酸盐在分解过程中会形成氧化铜与氧化锌的夹层界面, 部分碳酸盐会陷入到这一界面中, 这部分碳酸盐分解需要的温度比普通碳酸盐更高。且氧化铜与氧化锌间的相互作用越强, 形成的高温碳酸盐的分解温度就越高。而这一部分碳酸盐在后续反应过程中可以放出CO2, 进而有利于催化作用[19, 20, 21]。从DTG曲线还可以看出, 焙烧温度越高, 残留高温碳酸盐的分解温度就越高, 氧化铜与氧化锌间的相互作用也就越强。而350 ℃焙烧的粉料中残留的高温碳酸盐最多, 对催化的促进作用最强。这可能是因为高温焙烧导致前驱体中的碳酸盐分解时形成更多的CuO与ZnO夹层界面, 因而形成更多的高温碳酸盐, 但当焙烧温度达到400℃时, 部分高温碳酸盐又会开始分解, 因此残留的高温碳酸盐量比350℃& 4 h焙烧的要少。而300 ℃& 4 h和300 ℃& 6 h焙烧的粉料中残留的高温碳酸盐的量几乎相等。这与催化剂活性测试结果相一致。
图5是不同焙烧温度下制备的催化剂在100 k倍扫描电镜下得到的形貌图。从图5可以看出, 上述催化剂结构十分相似, 均为颗粒团聚体。但高温焙烧的催化剂较低温焙烧的催化剂结构更为致密, 这是由于高温焙烧后催化剂微孔结构遭到破坏, 比表面积和孔容减小, 这与N2低温吸附-脱附结果相一致。并且400 ℃焙烧的催化剂颗粒明显比300 ℃焙烧的要大, 说明焙烧温度的升高有利于晶粒的生长。
为了比较不同焙烧温度下制备的催化剂样品低温活性与高温稳定性, 测试了各催化剂老化前后的CO转化率和甲醇时空产率, 结果见表4。从表4可以看出, 各催化剂新鲜活性均达到80%以上, 350 ℃& 4 h焙烧得到的催化剂新鲜活性最好。老化后, 各催化剂CO转化率差异较为明显, 350 ℃& 4 h焙烧得到的催化剂CO转化率仍是最高, 400 ℃& 4 h焙烧得到的催化剂老化后CO转化率已经降到75.7%。300 ℃下焙烧4 h和6 h得到的催化剂新鲜活性和高温稳定性差别不大。测试得到的甲醇时空产率与CO转化率呈现出相同规律。结合表征结果来看, 与300 ℃焙烧相比, 350 ℃下焙烧得到的催化剂样品铜锌间相互作用强, 残留更多的高温碳酸盐, 有利于催化剂活性的提升。但400 ℃下焙烧温度过高, 催化剂表面铜含量低, 比表面积小, 不利于活性的提升。因此, 350 ℃为Cu-Zn-Al-Mg甲醇合成催化剂的最适宜焙烧温度, 300 ℃下适当延长焙烧时间得到的催化剂无法达到相同性能水平。
| 表4 催化剂的催化性能 Table 4 Catalytic activity of catalysts |
通过对共沉淀法制备的Cu-Zn-Al-Mg甲醇合成催化剂进行物化表征及活性评价, 可以得知:适宜的焙烧温度有利于催化剂低温活性及高温稳定性的提升; 350 ℃为Cu-Zn-Al-Mg甲醇合成催化剂的最适宜焙烧温度。焙烧温度过低, 催化剂中铜锌组分间相互作用弱, 形成的高温碳酸盐量少, 对催化促进作用差; 焙烧温度过高, 导致CuO晶粒大, 铜的分散性差, 且催化剂中微孔结构容易遭到破坏, 导致催化剂比表面积小, 且温度达到400 ℃, 焙烧过程中形成的高温碳酸盐也会逐渐开始分解, 对催化的促进作用减弱。因此, 350 ℃& 4 h焙烧得到的Cu-Zn-Al-Mg甲醇合成催化剂具有最好的低温活性及高温稳定性, 在300 ℃下延长焙烧时间无法使催化剂达到相同性能水平。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|