作者简介:李贵贤,1966年生,男,博士,教授,研究方向为催化剂创制与应用、催化反应工程与工艺、化工过程开发与强化。
采用离子交换法制备一系列不同钒含量的HZSM-5负载钒催化剂x%V2O5/HZSM-5,采用XRD、FT-IR、SEM、TEM、EDS、Mapping、N2物理吸脱附和XPS等对催化剂物化性能进行表征。结果表明,在最优条件下,以V元素的质量分数为基准,5%V2O5/HZSM-5催化剂在苯羟基化制苯酚反应中凸显最佳催化性能,苯转化率为43.4%,苯酚选择性超过98%,同时也表现出良好的催化稳定性。基于表征和实验结果,对催化剂的构效关系进行分析,为实现工业化提供了技术和理论支持。
A series of HZSM-5 supported vanadium catalysts(x%V2O5/HZSM-5)with different vanadium content were prepared by ion exchange method,and the physicochemical properties of the catalysts were characterized by means of XRD,FT-IR,SEM,TEM,EDS,Mapping,physical N2absorption-desorption,and XPS to explain the relationship between the structure of the catalysts and the catalytic activity.The 5%V2O5/HZSM-5 catalyst based on the mass fraction of element V showed the best catalytic performance with a benzene conversion of 43.4%and a phenol selectivity of over 98%under the optimal conditions,and it also showed good catalytic stability.The structure-activity relationship of the catalyst was analyzed based on the characterization and experimental results,which provides technical and theoretical support for industrialization.
苯酚是一种重要的化工有机中间体, 在纤维、塑料、医药、农药、香料、涂料、染料和精炼工业领域中具有广泛应用, 如酚醛树脂和双酚A的生产[1, 2]。目前, 世界上超过90%的苯酚由三步异丙苯法生产, 但由于其工艺流程长、反应条件苛刻、原子利用率低及产生等摩尔量的丙酮作为副产物等缺点, 限制了该方法在工业上大规模应用[3]。因此, 寻找一种绿色环保的苯酚合成路径非常必要。
近年来, 受资源匮乏及环境污染等严峻考验, 化工产品的绿色生产已引起世界各国的关注。故大力推进苯直接羟基化制苯酚的研究成为焦点。然而, 在理论上苯羟基化制苯酚反应存在一定的难度:(1) 反应涉及稳定的C— H键的活化; (2) 苯的共轭效应有利于亲电反应, 而[OH]或[O]是亲核的; (3) 目的产物苯酚比原料苯更易于被氧化[4]。因此, 苯羟基化制苯酚是一个具有挑战性的课题。迄今为止, 国内外研究者基于不同的氧化剂, 探索开发高效羟基化催化剂。
H2O2作为一种绿色环保型氧化剂, 在苯羟基化制苯酚反应中表现出优异的催化活性, 以原子利用率高、反应条件温和、副产物为水等优势获得科研工作者的青睐, 也是最有希望取代异丙苯法制苯酚的清洁生产工艺[5, 6]。为了获得高产率的苯酚, 与氧化剂契合的催化剂选择至关重要。Zhou Y等[1]采用离子液体直接合成V-Si/HZSM-22多相催化剂, 使用化学计量的H2O2氧化苯制苯酚, 收率达30.8%(选择性> 99%)。Hu L Y等[7]采用汽化诱导自组装法合成钒基介孔碳和介孔碳纳米管催化剂。由于3D开放式框架和短通道, 可使反应物快速扩散以结合大量活性钒物种, 从而加快反应物快速活化并进行表面羟化反应, 在优化条件下苯转化率38.2%, 苯酚选择性96.1%。Wang C等[8]合成的8V/g-C3N4催化剂表现出苯转化率24.6%, 苯酚选择性99.2%, 且回收率稳定。Ding G D等[9]发现V/g-C3N4催化剂在苯羟化反应中获得良好的催化活性, 苯酚是惟一的反应产物, 经XPS表征结果推测, g-C3N4表面上同时存在V2O5和VO2。Molinari R等[10]研究表明, 钒源会对苯羟化性能产生影响, 与乙酰丙酮钒(Ⅳ )相比, 使用氯化钒(Ⅲ )可获得更好的苯酚产率, 为35.2%。众所周知, 普通分子筛催化剂具有高比表面积和适宜酸量, 这有利于活性组分均匀分散在载体表面以暴露更多的催化活性位点, 进而提高苯酚产率[11, 12]。另外, 大多数氧化反应均属于酸催化反应, 所以在苯催化制苯酚反应体系中加入适量的酸有利于提高苯酚选择性。催化剂表面的酸性增强, 反应生成的苯酚越容易被质子化, 从而抑制进一步的亲电反应(该反应将导致苯酚深度氧化生成苯二酚或苯醌), 使苯酚选择性提高[4]。
本文通过离子交换法制备一系列钒基催化剂, 采用XRD、FT-IR、SEM、TEM、EDS、Mapping、N2吸附-脱附和XPS等对催化剂物化结构进行测试。通过苯羟基化制苯酚反应评估其催化性能, 研究各种反应条件对苯羟化制苯酚反应性能的影响。
苯、偏钒酸铵, 分析纯, 烟台双双化学有限公司; 乙腈、乙酸, 分析纯, 国药化学试剂有限公司; H2O2, 质量分数30%, 柠檬酸, 分析纯, 天津大帽化学试剂厂; HZSM-5分子筛(Si与Al物质的量比为80), 卓然环境技术(大连)有限公司。所有试剂无需纯化即可直接使用。
X射线衍射仪, D/MAX-2400型, 日本理学公司; 傅里叶变换红外光谱仪, Nicolet Nexus 670型, 赛默飞世尔科技公司; 扫描电子显微镜, FEI-Apreo型, 赛默飞世尔科技公司; 透射电子显微镜, FEI-Talos F200s型, 赛默飞世尔科技公司; 物理吸附仪, Autosorb-iQ型, 美国康塔仪器公司; X射线光电子能谱仪, PHI5702型, 日美纳米表面分析仪器公司; 气相色谱仪, GC7890II型, 美国安捷伦科技有限公司; 真空干燥箱, DZF型, 上海坤天实验室仪器有限公司; 程序箱式电炉, SXL-1008型, 杭州卓驰仪器有限公司。
将一定量的偏钒酸铵溶于60 mL去离子水中, 在连续搅拌下缓慢加入计算量的HZSM-5(Si与Al物质的量比为80)分子筛, 继续搅拌20 min后移至100 mL三口烧瓶中, 在100 ℃油浴锅中加热回流3 h。然后将混合物过滤, 并用去离子水洗涤3次, 最后将样品于110 ℃干燥12 h, 550 ℃焙烧6 h。所制催化剂标记为x%V2O5/HZSM-5, 其中, x%表示金属钒元素在催化剂中的百分含量, 即x%=m(V):m(催化剂)。
将乙腈15 mL、苯4 mL、催化剂0.2 g和柠檬酸0.075 g(0.39 mmol)加入100 mL三口烧瓶中, 在配有机械搅拌器的水浴中加热至70 ℃后缓慢滴加30%H2O2溶液12.5 mL, 滴加完毕后继续反应7 h。然后将产物冷却并离心分离, 取上清液进行气相色谱分析。使用配有FID检测器、SE-30毛细管柱(50 m× 0.53 mm× 1 μ m)的GC7890Ⅱ 气相色谱仪检测反应产物, 高纯度氮气作载气。进样口温度240 ℃, 检测器温度240 ℃。柱温采用程序升温, 初始温度60℃, 初始时间3 min, 以15 ℃· min-1速率升温至200℃, 恒温保持1 min。微注射器注射量为0.2 μ L, 采用面积归一法计算苯转化率与苯酚选择性。
2.1.1 XRD
图1为HZSM-5和不同钒质量分数的V2O5/HZSM-5催化剂的XRD图。
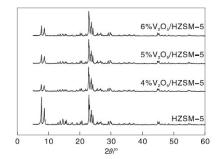 | 图1 HZSM-5和不同钒质量分数的V2O5/HZSM-5催化剂的XRD图Figure 1 XRD spectra of HZSM-5 and V2O5/HZSM-5 catalysts with different V contents |
由图1可看出, 在2θ =7.84° 、8.74° 、22.92° 、23.86° 和24.39° 时, 可以观察到明显的特征衍射峰, 而且在负载金属后所有特征峰均与HZSM-5分子筛的结构衍射峰一致, 均具有MFI型骨架结构[3, 13]。变化之处在于2θ =7.84° 和8.74° 的衍射峰强度有所降低, 表明催化剂结晶度减小, 主要与HZSM-5分子筛结构的轻微破坏有关。然而, 通过离子交换法制备的V2O5/HZSM-5催化剂的XRD衍射图未检测到V2O5特征衍射峰, 这可能是由于V2O5在HZSM-5分子筛表面的负载量均未超过其分散阈值, 而且呈高度均匀的单层分散状态[8]。
2.1.2 FT-IR
图2为HZSM-5和不同钒质量分数的V2O5/HZSM-5催化剂的FT-IR图谱。
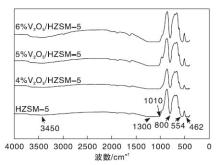 | 图2 HZSM-5和不同钒质量分数的V2O5/HZSM-5催化剂的FT-IR谱图Figure 2 FT-IR spectra of HZSM-5 and V2O5/HZSM-5 catalysts with different V contents |
由图2可知, 所有样品的骨架特征红外光谱峰在(400~1 600)cm-1。其中, 462 cm-1附近的吸收峰归因于Si— O键的弯曲振动, 554 cm-1附近的吸收峰为双环特征吸收峰, 800 cm-1附近的吸收峰主要是由于Si— O— Si键的对称拉伸振动引起[14], (1 010~1 300)cm-1的吸收带是外部或内部反对称拉伸振动引起的特性吸收峰, 在3 450 cm-1为— OH基团的伸缩振动峰[15]。然而, 在所有催化剂的红外光谱中均未观察属于钒氧化物的吸收峰, 这可能是由于钒氧化物的低负载量或钒氧化物高度分散在催化剂表面。
2.1.3 SEM和TEM
图3为不同钒质量分数的V2O5/HZSM-5催化剂的SEM和TEM照片。由图3可见, HZSM-5分子筛呈表面光滑的八面沸石笼状结构, 表明结晶度较高[16]。引入金属后, 未造成催化剂形貌变化, 而且在催化剂表面也没有明显的金属颗粒存在, 表明金属负载量较低, 且高度分散在催化剂表面, 这也可以通过TEM-Mapping表征结果证明。
 | 图3 不同钒质量分数的V2O5/HZSM-5催化剂的SEM和TEM照片Figure 3 SEM and TEM images of HZSM-5 and V2O5/HZSM-5 catalysts with different V contents |
2.1.4 EDS和Mapping
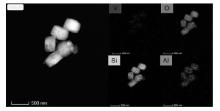
图4为HZSM-5分子筛和5%V2O5/HZSM-5催化剂的EDS谱图。由图4可以看出, 在5%V2O5/HZSM-5催化剂中除活性成分V元素外, 催化剂中还存在其他5种元素, 即Si、O、Al、C和Cu。其中 Si和Al是HZSM-5分子筛的组成元素, V是主要的催化活性中心, Cu是测试时呈于铜网上而引入的杂质元素。
图5为5%V2O5/HZSM-5催化剂的Mapping照片。
由图5可以看出, 在HZSM-5沸石表面形成了钒的均匀分布状态, 论证了XRD和FT-IR结果。
2.1.5 N2吸附-脱附和孔径分布
图6为HZSM-5和V2O5/HZSM-5催化剂的N2吸附-脱附等温线和孔径分布。由图6可以看出, 所有催化剂均表现出典型的Ⅳ 型等温线, 在低压端曲线偏向于Y轴, 表明催化剂与氮气有较强的作用力, 材料中一定存在微孔结构。在中压段出现明显的H3型回滞环, 这主要是由于毛细管凝聚现象引起[17]。
表1为催化剂的物化性能。由表1可见, 在负载钒氧化物后孔径尺寸基本无变化, 催化剂的比表面积和孔体积均减小, 这主要是负载钒氧化物过程中, 除了在催化剂表面高度分散外, 还有一部分钒氧化物进入催化剂孔道, 使得HZSM-5沸石孔道结构被堵塞, 造成比表面积和微孔体积减小[11, 18]。
| 表1 催化剂物化性能 Table 1 Physical and chemical properties of the catalyst |
2.1.6 XPS
图7为5%V2O5/HZSM-5催化剂反应前后的XPS曲线。由于电子的轨道运动和自旋运动发生耦合作用[19], 使催化剂样品的V2p区域发生分裂, 产生520.8 eV和517.2 eV附近的两个峰, 分别归因于V2p1/2和V2p3/2, 表明金属主要以V5+形式存在, 其对应的氧化物可能以V2O5为主[20, 21]。反应后, V元素出峰位置发生明显变化, (1) 反应后所有出峰位置均向高结合能移动, 此化学位移主要是由于发生氧化作用引起。(2) 使用过的催化剂中出现以516.7 eV为中心的峰, 表明反应过程中有部分V5+转换成V4+, 其对应的氧化物可能以VO2为主, 即元素V以混合价态存在。(3) 以522.8 eV和523.2 eV为中心的峰为其他元素产生的干扰峰[22, 23]。
在催化剂0.2 g、苯4 mL、30%H2O212.5 mL、乙腈15 mL、柠檬酸0.075 g和温度70 ℃、时间7 h条件下, 不同催化剂催化苯羟化反应活性如表2所示。由表2可知, HZSM-5对苯羟化制苯酚反应基本没有催化活性。HZSM-5表面负载钒氧化物后, 其催化活性显著增加, 表明钒氧化物是该催化体系的活性中心。随着负载量增加, 苯转化率和苯酚选择性逐渐增加, 这主要是由于活性组分的增加促进了其与氧化剂的作用, 使得在反应体系中羟基自由基的增加, 进而增加其催化活性。进一步增加钒含量, 可能导致活性物种在分子筛表面发生团聚, 堵塞了分子筛孔道结构, 造成比表面积大大降低, 有效活性组分不能被充分利用, 使苯酚产率下降[13, 22]。反应产物中除苯酚外, 还有少量的对苯二酚和对苯醌等副产物生成。
| 表2 不同催化剂催化苯羟化反应活性 Table 2 Catalytic activity of different catalysts for benzene hydroxylation |
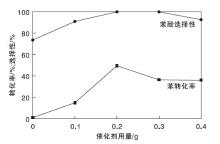
2.2.1 催化剂用量对反应性能的影响
催化剂用量对反应性能的影响如图8所示。
由图8可见, 不加催化剂时, 苯转化率和苯酚选择性分别为1.3%和74.0%。随着催化剂用量的增加, 苯酚转化率呈火山型曲线, 当催化剂用量为0.2 g时, 转化率达50.3%, 选择性接近100%, 这主要是由于催化剂用量的增加可以提供更多的活性中心, 促进苯酚的生成[13]。但是过量的催化剂不仅加速了苯酚的进一步氧化, 而且加快H2O2的自分解, 降低氧化剂有效利用率, 导致苯酚产率降低[9]。
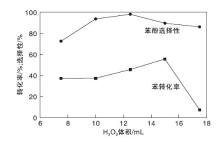
2.2.2 H2O2含量对反应性能的影响
从化学计量看, 苯羟基化反应是等摩尔反应, 其苯和H2O2的量是相等的。但由于在反应中, H2O2除了可以产生羟基自由基氧化苯制苯酚外, 还有一部分发生自身分解, 因此为了提高催化产率, 加入过量的氧化剂是必要的[17]。H2O2含量对反应性能的影响如图9所示。
由图9可以看出, 当H2O2含量较少时, 反应中的自由基较少, 不足以使苯大量转化。随着H2O2含量增加, 苯酚选择性先增后减, 这主要是由于过量的氧化剂会产生大量的自由基, 使未及时从催化剂上脱附下来的苯酚发生深度氧化, 导致苯酚选择性降低。当H2O2为12.5 mL时, 苯转化率为45.5%, 苯酚选择性达98.0%, 达到最佳值。
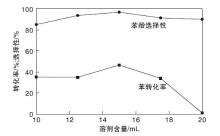
2.2.3 溶剂含量对反应性能的影响
溶剂在液相催化反应中具有稀释、分散以及传输物质的作用。恰当量的溶剂可以促进反应物分子间及其与催化剂表面的接触, 对反应的进行和产物分布具有一定的影响[24, 25]。溶剂含量对催化剂性能的影响如图10所示。
由图10可以看出, 随着乙腈含量的增加, 苯转化率和苯酚选择性呈先增后降的趋势, 当溶剂为15 mL时, 苯转化率为46.6%, 苯酚选择性达96.9%。这可能是由于乙腈含量的增加, 使反应物均足以溶解于溶剂中, 反应物之间的接触几率大大增加, 进而加速反应进行。但过量的溶剂使稀释效应增加, 限制了反应物接触到催化剂活性位点, 使苯酚转化率下降。
2.2.4 柠檬酸含量对反应性能的影响
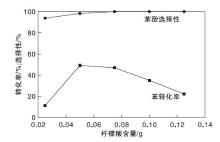
苯羟化制苯酚反应为酸催化反应, 增加反应体系的酸性, 有利于催化剂性能的提高。柠檬酸含量对催化剂性能的影响如图11所示。
随着柠檬酸含量的增加, 苯转化率呈火山型曲线, 而苯酚选择性升高到一定程度后保持不变, 柠檬酸含量为0.075 g时, 苯转化率达41.6%, 苯酚选择性接近100%。这主要是由于一定量的酸性加快苯羟化反应, 进而增加苯酚产率, 但强酸将加速H2O2的分解, 使反应体系中的OH自由基较少, 苯转化率降低[5, 26]。由于苯酚在酸性环境下被质子化, 从而抑制苯酚进一步的亲电反应(苯酚过度氧化生成苯二酚或对苯醌), 有效提高苯酚产率。
2.2.5 反应温度对反应性能的影响
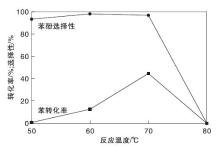
反应温度对催化剂性能的影响如图12所示。
由图12可以看出, 反应温度较低时, 催化剂基本不产生催化活性。随着反应温度升高, 苯转化率和苯酚选择性表现出先升后降的趋势, 在温度70 ℃时, 苯转化率达44.6%, 苯酚选择性为96.8%。这主要是由于温度升高可以提供更多的能量使苯环上的C— H键断裂, 使反应更加容易进行。但是温度过高会造成H2O2大量分解, 迫使苯转化率降低[23], 另外由于苯酚比苯更容易发生氧化, 所以温度过高苯酚将发生深度氧化生成苯二酚及对苯醌[27]。由于苯的沸点为80.1 ℃, 所以当温度为80 ℃时, 反应物苯严重挥发, 反应将不再进行[29]。
2.2.6 反应时间对反应性能的影响
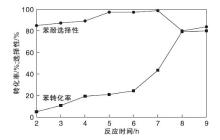
反应时间对催化剂性能的影响如图13所示。
由图13可以看出, 反应开始时体系中生成的自由基含量较少, 只有少量的苯发生反应。随着反应时间延长, 苯转化率逐渐增加, 而苯酚选择性呈先升后降的趋势。在反应时间7 h时, 苯转化率达43.4%, 苯酚选择性为98.9%。这主要是由于反应时间延长, 反应体系中生成的OH自由基增多, 加快与苯的反应使苯转化率增大。但是反应时间过长会造成苯酚发生深度氧化, 使苯酚选择性下降, 另外, 催化剂表面聚集的有机物增多也会造成催化剂失活。
2.2.7 溶剂种类对反应性能的影响
一方面, 溶剂可以促进反应物之间的接触, 加快反应的进行。另一方面, 由于不同溶剂的自身性质可以影响催化反应的进行, 或与氧化产物相互作用, 从而影响反应活性以及产物的分布。溶剂种类对苯羟化反应的影响如表3所示。由表3可以看出, 以乙腈为溶剂时, 催化剂有较好的苯酚产率。当溶剂为乙酸或混合溶剂时, 苯酚选择性有所上升, 但苯转化率较低, 这可能与乙酸提供的酸性环境以及配位作用有关[29]。
| 表3 溶剂种类对苯羟化反应的影响 Table 3 Effect of solvent types on benzene hydroxylation reaction |
通过5%V2O5/HZSM-5进行苯羟基化制苯酚反应工艺条件优化实验, 在催化剂用量0.2 g、苯4 mL、30%H2O212.5 mL、乙腈15 mL、柠檬酸0.075 g(0.39 mmol)、温度70 ℃和反应时间7 h条件下, 苯转化率为43.4%, 苯酚选择性达98.9%。通过表征及实验论证, 催化剂具有高效的催化性能主要原因在于活性中心钒氧化物能够高分散于载体HZSM-5表面及间接控制活性中心的高效空间利用。其次, 催化剂活性中心钒氧化物的价态对反应有很大的影响, 通过实验观察, 起初催化剂催化速率较慢, 2 h转化率约5%, 3 h转化率约10%, 5 h后催化剂转化率大大提高, 约20%, 通过XPS检测表明, 催化剂表面V5+变为V5+和V4+的混合态, 即经苯羟基化高效制苯酚, 基于钒氧化物为活性中心, 混合价态是最佳催化环境。为了促进反应, 柠檬酸的引入对反应的高效进行起不可取代的作用, 主要原因可能是柠檬酸能够激发催化剂活性中心的氧化性能及促进物质的扩散等作用。
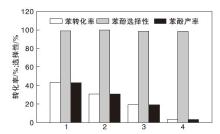
催化剂重复性能如图14所示。
由图14可见, 催化剂重复使用4次, 苯酚选择性略有减小, 而苯酚产率出现大幅下降。这可能是由于催化剂中活性中心的严重流失导致苯转化率降低。其次, 在酸性环境中, 钒离子聚集形成复杂的表面钒物种, 反应体系的一些组分被吸附在催化剂表面或孔道里, 不仅占据了催化剂活性位点, 而且还减小了催化剂比表面积, 降低催化剂吸附性能, 影响催化剂催化活性。因此, 对使用后的催化剂进行适当的活化处理, 延长其使用寿命, 即将用过的催化剂在110 ℃干燥12 h, 550 ℃焙烧6 h, 然后回收用于下一次催化反应过程, 解决催化剂活性再生问题。
采用简单的方法合成了高分散V2O5/HZSM-5催化剂, 并用于苯羟基化反应评估催化剂性能。结果表明, 具有微孔结构的5%V2O5/HZSM-5催化剂以H2O2为氧化剂、乙腈为溶剂、柠檬酸为添加剂时, 对苯羟基化制苯酚反应具有高效的催化活性和高选择性。其原因不仅在于活性中心钒氧化物能够被高度均匀分散于载体上, 以及金属钒以混合价态的形式存在, 而且柠檬酸的添加为苯羟化反应提供了最佳酸催化反应环境, 有利于提高苯转化率和苯酚选择性。在催化剂用量0.2 g、苯4 mL、30%H2O212.5 mL、乙腈15 mL、柠檬酸0.075 g(0.39 mmol)、温度70 ℃和反应时间7 h条件下, 苯转化率为43.4%, 苯酚选择性达98.9%, 同时催化剂表现出良好的重复性能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|