作者简介:张可羡, 1991年生,女,陕西省西安市人,工程师,研究方向为工业催化。
采用二步共沉淀法,选取不同沉淀剂Na2CO3、K2CO3和NaHCO3制备Cu-Zn-Al-Mg合成甲醇催化剂,考察不同沉淀剂对催化剂性能的影响。采用N2低温吸附、XRD、H2-TPR和TG-DTG等对样品进行分析,结果表明,K2CO3为沉淀剂时,催化剂前驱体中锌铝水滑石物相多且结晶好, Na2CO3为沉淀剂时,催化剂前驱体中有更多的Zn2+发生取代生成(Cu,Zn)2(OH)2CO3物相,有利于CuO分散, NaHCO3为沉淀剂时,催化剂比表面积小,平均孔径及CuO晶粒尺寸大。
A two-step co-precipitation method was used to prepare Cu-Zn-Al-Mg methanol synthesis catalysts with different precipitants,such as Na2CO3,K2CO3 and NaHCO3.The effects of precipitant on catalyst performance were investigated.The properties of catalysts were characterized by N2 adsorption-desorption,XRD,H2-TPR,and TG-DTG.The results showed that K2CO3 as precipitant was conductive to form well-crystallized Zn-Al hydrotalcite in catalyst precursor and Na2CO3 as precipitant was beneficial to Zn2+substitution in the precursor to form(Cu,Zn)2(OH)2CO3phase and copper dispersion,while catalyst prepared with NaHCO3 had smaller specific surface area and larger average pore size and CuO grain.
甲醇是基本的有机化工原料, 其下游副产品多种多样, 可用于制备低碳烯烃(MTO和MTP)、甲醛、醋酸、甲胺和甲酸甲酯等产品[1, 2, 3], 同时甲醇又是一种优质的清洁燃料, 也可作为汽车燃料的优质添加剂[4, 5]。目前工业上主要采用一氧化碳加氢合成甲醇, 而合成甲醇催化剂是整个工艺的核心, 因此研究其催化活性与热稳定性具有重要意义。自ICI最早推出的Cu-Zn-Al体系催化剂成功应用于工业生产以来, 人们对这类高效合成甲醇催化剂体系的深入研究从未止步[6, 7]。目前工业上大多采用沉淀法制备甲醇合成催化剂, 沉淀反应的各个过程均影响催化剂性质, 进而影响催化活性及高温稳定性能[8, 9]。沉淀过程中形成的Cu2(OH)2CO3、(Cu, Zn)2(OH)2CO3、(Cux, Zn1-x)5(CO3)2(OH)6、Zn1-xAlx(OH)2(CO3)x/2· mH2O及[(Cu, Zn)1-xAlx](OH)2(CO3)x/2· mH2O是甲醇合成催化剂前驱体主要物相[10, 11, 12, 13], Zn1-xAlx(OH)2(CO3)x/2· mH2O焙烧后能形成稳定的骨架结构; (Cu, Zn)2(OH)2CO3和(Cux, Zn1-x)5(CO3)2(OH)6热分解后形成CuO/ZnO固溶体, 固溶体热还原后, 活性组分Cu与ZnO之间能够形成强的协同作用, 有效防止活性组分Cu烧结[14, 15, 16, 17]。研究[2, 18, 19, 20, 21, 22]表明, 沉淀剂影响催化剂的前驱体结构、种类及结晶程度, 还影响孔道结构和还原性能等。常用的沉淀剂有Na2CO3、K2CO3、NaHCO3和(NH4)2CO3, 铵盐易生成铜铵络离子而造成活性组分流失[23]。本文以Cu-Zn-Al-Mg为体系, 采用二步共沉淀法, 研究沉淀剂Na2CO3、K2CO3和NaHCO3对合成甲醇催化剂性能的影响。
Cu(NO3)2· 3H2O、Zn(NO3)2· 6(H2O)、Al(NO3)3· 9(H2O)、Mg(NO3)2· 6H2O、Na2CO3、K2CO3和NaHCO3, 均为分析纯, 国药集团化学试剂有限公司; 石墨为鳞片石墨, 青岛天盛达石墨有限公司。
将Al(NO3)3· 9(H2O)和Zn(NO3)2· 6(H2O)溶于去离子水中配成1.0 mol· L-1混合盐溶液A; 将Cu(NO3)2· 3H2O、Zn(NO3)2· 6(H2O)及Mg(NO3)2· 6H2O配成1.0 mol· L-1混合盐溶液B, 其中n(Cu2+):n(Zn2+):n(Al3+):n(Mg2+)=16:6:4:1。将Na2CO3、K2CO3和NaHCO3分别配成1.0 mol· L-1碱溶液。采用二步共沉淀法制备铜基催化剂:(1)将盐溶液A与Na2CO3溶液并流滴入烧瓶中, 恒温70 ℃控制pH≈ 7.0, 搅拌, 至A滴完; (2)将溶液B与Na2CO3溶液继续并流到上述烧瓶中, 搅拌, 恒温70 ℃控制pH≈ 7.0; 溶液B滴定完毕后继续在同温下老化2 h, 过滤, 充分洗涤, 110 ℃烘干8 h, 得催化剂前驱体, 350 ℃焙烧4 h得焙烧粉料, 加入一定量石墨(质量分数2%)经成型得到铜基催化剂, 记为Cat-Na。采用上述方法, 制备沉淀剂分别为K2CO3、NaHCO3的铜基催化剂, 分别记为Cat-K和Cat-HNa。
采用Bruker公司的D8型X射线衍射仪表征样品的物相结构, CuKα , 工作电压40 kV, 工作电流40 mA, 扫描速率10 o· min-1, 步长0.02, 扫描范围2θ =10o~80o。
样品织构性能采用美国麦克仪器公司2020物理吸附仪测定, 将约200 mg样品300 ℃抽真空预处理7 h, 以N2为吸附质, 在-196 ℃下进行吸附量及吸-脱附曲线的测定。样品为BET比表面积, 孔容及平均孔径为BJH数据。
采用美国麦克仪器公司2920化学吸附仪对样品的还原性能进行表征, 样品用量50 mg, 在20 mL· min-1的Ar下程序升温至200 ℃保持1 h进行预处理后冷却至室温, 再切换为20 m L· min-1的还原气(10%H2-Ar), 并以5 ℃· min-1程序升温还原, TCD检测。
采用梅特勒-托利多TGA/DSC 3+型同步热分析仪对样品的热分解过程进行分析。样品用量40 mg, 升温速率10 K· min-1, 从50 ℃升至150 ℃, 恒温30 min, 然后从150 ℃升至800 ℃, 研究样品的热失重过程。
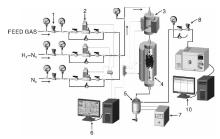
采用固定床连续流动反应装置评价催化剂活性。取2 mL(20~50)目催化剂颗粒与等粒度同体积惰性磁环混合均匀装入反应管。将催化剂在5%H2-N2气氛下程序升温还原, 4 h将室温升至170 ℃恒温2 h, 然后2 h升温至220 ℃恒温2 h。还原完后切换成原料气(体积分数CO=13.0%~14.0%, CO2=4.0%~5.0%, N2=10%, 其余为H2), 在5.0 MPa, 空速10 000 h-1, 温度(235~245)℃条件下反应, 测得稳定的CO转化率及甲醇产率, 随后降压至0.1 MPa, 温度升至400 ℃, 空速降为3 000 h-1, 在此条件下老化10 h, 老化完毕后, 降温至(235~245)℃, 测得老化后稳定的CO转化率及甲醇产率。采用1台Agilent 7890A气相色谱在线分析尾气组成。整个分析流程有3个并联的分析单元:分析C1~C6烃类, 配制一根HP-PLOT“ S” Al2O3柱子和一个FID检测器; 分析CO、CO2和N2, 配制一根5A分子筛柱, 2根ProPackQ柱和1个TCD检测器; 分析H2的检测器, 配制1根5A分子筛柱, 1根ProPackQ柱和1个TCD检测器。液相分析釆用Agilent8890色谱仪, 配置HP-INNOWax 60 m× 320 μ m× 0.5 μ m毛细柱, FID检测器, 1 μ L自动进样, 分流比30:1, 程控升温。甲醇合成催化剂评价装置如图1所示。
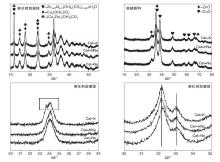
图2为催化剂前驱体和焙烧粉料的XRD图。
由图2可以看出, 采用不同沉淀剂的催化剂前驱体峰形类似, 均检测到(Cu, Zn)2(OH)2CO3、Cu2(OH)2CO3和Zn0.63Al0.37(OH)2(CO3)0.185· xH2O物相, 且锌铝水滑石物相在Cat-K的前驱体中最多, 表明沉淀剂为K2CO3时, 有利于前驱体中锌铝水滑石物相的形成。在2θ =24° 时, Cat-K前驱体峰形有明显分裂的趋势, 比对XRD图卡可知, Cat-K前驱体物相中存在结晶度较好的锌铝水滑石相。在2θ =32.2° 时, Cat-Na峰位明显向高角度偏移, 表明沉淀剂为Na2CO3时, 前驱体物相中有更多的Zn2+发生取代而生成(Cu, Zn)2(OH)2CO3物相[11, 14]。
由图2还可以看出, 焙烧粉料主要以CuO及ZnO物相为主, 未检测到Al2O3特征峰, 表明Al2O3在焙烧粉料中是以分散状态或者无定型方式存在。以2θ =38.8° (111晶面)为基准, 通过Scherrer公式计算CuO晶粒尺寸。N2低温吸附的催化剂样品织构参数如表1所示。
| 表1 催化剂织构参数 Table 1 Textural properties of calcination catalysts |
由表1可以看出, 沉淀剂不同, CuO晶粒尺寸也不同。NaHCO3为沉淀剂时, CuO晶粒尺寸最大, Na2CO3和K2CO3为沉淀剂时, CuO晶粒尺寸相差不大。催化剂活性与热稳定性不仅与晶粒尺寸相关, 也同CuO与ZnO之间的相互作用相关, 催化剂前驱体经焙烧后生成CuO与ZnO, CuO与ZnO之间相互作用的强弱影响CuO分散, 进而影响CuO晶粒尺寸及还原的难易程度[14, 15]。
由表1还可以看出, 沉淀剂影响催化剂的织构性质。Na2CO3和K2CO3为沉淀剂时, 催化剂比表面积、平均孔径差别不大; NaHCO3为沉淀剂时, 催化剂比表面积明显小于Na2CO3和K2CO3, 孔容与平均孔径也较大。结合XRD可知, Cat-K前驱体中存在更多的锌铝水滑石物相, Cat-Na前驱体中存在更多的(Cu, Zn)2(OH)2CO3物相, 这两种物相在焙烧后都有利于提高催化剂比表面积; 沉淀剂为NaHCO3时, 由于CuO晶粒尺寸较大, 导致比表面积下降, 这与文献[18, 19]报道一致。
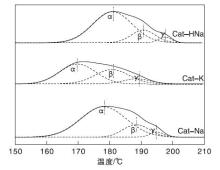
图3为催化剂的H2-TPR谱图及高斯拟合图。在实验温度条件下样品中ZnO和Al2O3不能被还原, 因此, 谱图中的耗氢峰源于催化剂中氧化态铜的还原。
由图3可以看出, TPR图谱明显由3个峰叠加在一起, 因此采用高斯函数分3个独立的峰。其中低温α 峰主要归属于类孔雀石及绿铜锌矿分解产生的CuO的还原, 此时CuO与ZnO之间相互作用强, CuO分散最好, 颗粒相对较小; 中温β 峰主要归属于孔雀石分解产生的CuO的还原, 此时CuO与ZnO之间相互作用弱; 高温γ 峰主要归属于体相CuO的还原, 此时CuO与ZnO作用最弱, 分散较差, 颗粒也相对较大[11, 17, 22]。
表2为催化剂的H2-TPR高斯拟合结果。
| 表2 催化剂的H2-TPR高斯拟合结果 Table 2 Gaussian fitting analysis of the H2-TPR profiles |
由表2可以看出, K2CO3为沉淀剂时, α 峰、β 峰和γ 峰还原峰温最低, Na2CO3和NaHCO3为沉淀剂时还原峰温相近。通过峰面积占比可以看出, Na2CO3和NaHCO3为沉淀剂时, 各峰占比基本相同, 表明CuO和ZnO之间具有相似的相互作用。K2CO3为沉淀剂时, 低温α 峰占比较小, 中温β 峰和高温γ 峰占比较大, 表明CuO和ZnO之间相互作用较弱, 且体相CuO占比较高, 不利于催化剂的低温活性和高温稳定性。
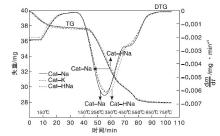
图4为催化剂前驱体的TG-DTG图谱。
由图4中TG曲线可以看出, 催化剂前驱体在(50~800)℃均存在2个主要的热失重阶段, 150 ℃前的失重主要源于催化剂前驱体中游离水及锌铝水滑石层间水的脱除, 150 ℃后的失重主要源于孔雀石、锌孔雀石和水滑石等碳酸盐的分解。从DTG曲线可以看出, 3个样品在约300 ℃均存在一个热分解峰, 其失重速率最大分解温度Cat-Na为305 ℃、Cat-K为314 ℃和Cat-HNa为329 ℃, 峰温依次升高。样品Cat-Na与Cat-K和Cat-HNa的曲线相比, 在480 ℃时还存在1个热分解峰, 来自“ 高温” 碳酸盐的分解, 这部分碳酸盐的分解会使催化剂微观结构更加稳定, 有利于催化剂高温稳定性能[11, 14, 17], 这与催化剂活性结果一致。
表3为催化剂老化前后CO转化率的变化。由表3可以看出, Na2CO3为沉淀剂时, 老化前后CO转化率均最高, 且CO转化率的下降率最小, Cat-K次之, Cat-HNa最差, 甲醇时空产率也呈现相似的规律。表明沉淀剂为Na2CO3时, 催化剂表现出优良的低温活性和高温稳定性, 这与催化剂前驱体中有更多的(Cu, Zn)2(OH)2CO3物相有关, 这种物相在焙烧后有利于CuO分散, 使催化剂的微观结构更加稳定, 并有效防止活性组分Cu的烧结, 有利于提高催化剂活性及高温稳定性。K2CO3为沉淀剂时, 催化剂的CuO晶粒尺寸和织构参数与Na2CO3为沉淀剂时相近, 但由于Cat-K中弱相互作用的CuO和体相CuO占比大, 导致低温活性和高温稳定性均不及Cat-Na。NaHCO3为沉淀剂时, 催化剂比表面积、平均孔径和CuO晶粒尺寸均较大, 不利于其低温活性和高温稳定性。
| 表3 催化剂老化前后CO转化率的变化 Table 3 CO conversion of the fresh and aged catalysts |
(1) Na2CO3为沉淀剂时, 催化剂前驱体中有更多的Zn2+发生取代生成(Cu, Zn)2(OH)2CO3物相, 有利于CuO分散, 形成小晶粒CuO, 催化剂表现出优良的活性和高温稳定性。
(2) K2CO3为沉淀剂时, 催化剂前驱体中锌铝水滑石物相多且结晶好, 催化剂还原温度低, 但样品中弱相互作用的CuO和体相CuO占比大, 不利于催化剂活性和稳定性。
(3) NaHCO3为沉淀剂时, 催化剂比表面积小、平均孔径和CuO晶粒尺寸大, 导致其活性和稳定性较差。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|