作者简介:李龙泰,1996年生,男,湖北省武汉市人,硕士,研究方向为CO2催化加氢。
人类向大气中排放的大量CO2造成一系列环境问题,极大地威胁了人类生存。采用CO2催化加氢方式,将CO2与H2转化为高附加值的下游化学品,既可以减少大气中CO2浓度,又可以生产具有经济价值的商品,具有良好的应用前景。CO2加氢平行反应众多,产物众多,选取4种常见的CO2加氢产物CO、CH4、CH3OH及烃类化合物,对其进行简要综述。
The large amount of carbon dioxide (CO2) emitted by humans into the atmosphere has caused a series of environmental problems and greatly threatened the survival of human beings. CO2 and H2 can be converted to high added value chemicals by hydrogenation of CO2,which can produce valuable products and had good application prospect.This paper selects four common CO2 hydrogenation products: CO, CH4, CH3OH and hydrocarbons,and briefly review the research progress.
由于人类的活动, 大气中CO2浓度逐年增加, 引发一系列全球气候及环境问题[1]。采用CO2作为碳源, 通过CO2催化加氢方式, 不仅可以减少温室气体的排放, 还可以将CO2转化为高附加值的化学产品, 具有重要的战略意义。
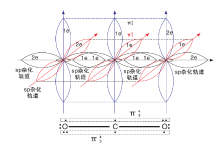
CO2是碳与氧反应的最终产物, 由一个碳原子和两个氧原子通过共价键构成(如图1)。CO2的分子结构为非极性线性对称三原子分子, 分子中共有16个价电子。位于中心的碳原子为sp杂化, 碳原子的2个sp杂化轨道分别与2个氧原子生成2个σ 键, 碳原子上2个未参加杂化的p轨道与sp杂化轨道成直角, 并且从侧面和氧原子的p轨道分别肩并肩地发生重叠, 生成2个
CO2加氢进行的多相催化反应包括反应物从气相扩散到催化剂颗粒间, 再扩散到催化剂并吸附到表面, 活化反应; 然后产物脱附、扩散到孔外, 再扩散到气流中完成催化反应历程。概括起来就是扩散、吸附、活化反应、脱附以及扩散5个步骤。而催化剂除了需要具备活化CO2分子的能力外, 还需要具备将H2分子解离为活性吸附态氢原子的能力[7, 8, 9]。
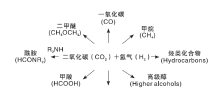
由于CO2加氢平行反应众多, 产物也众多。CO2加氢主要产品可分为燃料和化学品[7, 8, 9, 10](如图2)。随着能源消耗的增长, 全世界对燃料的需求不断增加, 然而地壳中的化石燃料资源有限, 近年来燃料的价格波动也很大, 因此, 利用非化石燃料资源和工艺开发替代化石燃料非常具有前景。CO2加氢产物如甲醇(CH3OH)、二甲醚(DME)和烃类化合物等都是内燃机的优良燃料, 同时也便于储存和运输[11]。甲烷(CH4)可直接采用现有的天然气管道储存和运输, 同样也是清洁燃料[12]。甲醇和甲酸是许多化学工业的原料和中间体, 一氧化碳可作为费托合成的原材料[13]。
如何设计具有高活性和高选择性的催化剂, 理解催化性能与催化剂组成结构间的构效关系, 确定催化剂活性中心, 是学术界关注的问题。本文综述CO2催化加氢研究进展。
CO2催化加氢制CO, 被称为逆水煤气反应(公式1)。反应生成的CO2/CO/H2混合气, 在除去其中的H2O副产物后, 可作为合成气用于费托合成或作为原材料用于生产甲醇。费托合成或甲醇合成, 都是非常成熟的化工过程, 所以CO2催化加氢制CO是一个非常重要的反应。RWGS反应催化剂研究主要集中在过渡金属和贵金属负载型催化剂上。
CO2+H2$\rightleftharpoons$CO + H2O;
过渡金属中, 铜基催化剂被广泛用于RWGS反应[14, 15, 16, 17]。Liu Y等[15]发现了一系列双金属Cu-Ni/γ -Al2O3催化剂用于CO2加氢制CO, Cu/Ni元素比例对催化剂活性和选择性都有较大影响。此外, Cu/ZnO[17]和Cu-Zn/Al2O3[16]也被用于RWGS反应。由于RWGS是吸热反应, 高温有利于CO生成。然而, 铜基催化剂热稳定性差, 在高温下Cu纳米颗粒容易发生烧结[18], 限制了铜基催化剂的应用。
贵金属负载型催化剂是CO2制CO最常见的催化剂。其活性物种主要有Pt[18, 19]、Pd[20]、Ru[21]、Rh[21]和Ir[22]等, 载体主要选择SiO2、CeO2、TiO2和Al2O3等, 其中贵金属可以促进H2解离, 而氧化物载体有利于CO2中C=O键裂解。贵金属纳米颗粒分散度和化学状态是影响催化剂性能的关键因素, 对反应物在催化剂上的吸附行为及之后的中间物种转化有较大影响。Li S等[22]报道了一种无配体一步合成均一分散的Ir/CeO2纳米催化剂方法。在该催化剂上, Ir和CeO2间存在金属-载体强相互作用(SMSI), Ir的化学状态可通过改变负载量来进行精准调控。在300 ℃和1.0 MPa条件下, Ir/CeO2催化剂可以100%选择性生成CO, 且CO2转化率达81.1 mo
过渡金属碳化物(TMCs)是近年来发现的新型CO2加氢制CO催化剂。在引入碳元素后, 过渡金属的电子性质发生变化, 使其性质变得和贵金属催化剂相似, 从而在CO2加氢制CO反应中展现高活性[23, 24, 25]。Mo2C是一种优良催化剂, 有较强的H2解离及C=O断键能力。Mo2C被用作一种更加经济的替代品用于RWGS反应, Posada-Pé rez S等[23]报道了一种多晶六方α -Mo2C在温和温度和压力条件下表现出高活性和CO选择性。在400 ℃、CO2和H2进料比1时, CO2转化率达16%, CO选择性大于99%。Lin Z等[24]报道了在Mo2C上引入Co元素, 可进一步提高其活性、选择性及稳定性。采用蒸发沉积将硝酸钴引入Mo2C中, 在300 ℃引入质量分数7.5%Co的Mo2C, 其CO2转化率从8.7%提高到9.5%, 产物中CO与CH4比由14.5升至51.3。其性能优于贵金属PtCo/CeO2催化剂[25](CO2转化率6.6%, CO与CH4比为4.5)。
CO2甲烷化反应最早由法国化学家Paul Sabatier提出, 被叫做Sabatier反应(公式2)。CO2甲烷化反应可以将CO2直接转化为能源气体, 是CO2加氢的一个重要反应过程, 具有较高的学术研究价值和工业化前景。CO2甲烷化为放热反应, 反应温度的升高不利于甲烷生成。从热力学角度考虑, 甲烷化适宜在低温条件下进行, 但从动力学角度考虑, 低温会导致反应速率降低。甲烷化主要挑战在于要同时达到高反应速率和高甲烷选择性, 因此需要催化剂来调控反应进行。
CO2 + 4H2 $\rightleftharpoons$CH4 + 2H2O;
常见的甲烷化反应催化剂为负载型金属催化剂, 活性组分通常为过渡金属元素, 如Co[26]、Ni[27, 28, 29, 30]、Ru[31, 32]、Rh[33]和Pd[34]等。过渡金属元素在CO2甲烷化反应中的活性顺序依次是Ru> Rh> Ni> Co> Pt> Pd[35]。Ru基和Rh基催化剂在CO2加氢制甲烷反应中具有最高的CO2转化率和CH4选择性。而Co基和Ni基催化剂由于廉价易得, 也受到学术界关注。其中Ni基催化剂研究较为成熟, 工业化应用以Ni基催化剂较为常见[28]。Co基催化剂被广泛应用在费托合成中作为链增长催化剂, 但在CO2加氢中的主要产物为甲烷[36]。CO2甲烷化催化剂载体主要有Al2O3、SiO2、ZrO2、TiO2和CeO2等[37]。
影响催化剂活性的主要因素有载体种类[37]、金属分散度[29]和金属粒径尺寸[32]等。Kattel S等[38]制备了PtCo/TiO2和PtCo/ZrO2不同载体的催化剂用于CO2加氢, 发现当载体从ZrO2替换成TiO2时, 产物从CH4变为高选择性生成CO。载体晶体结构会影响产物选择性, Lin Y等[39]将Ni负载在锐钛矿和金红石TiO2载体上应用于CO和CO2加氢反应, 发现Ni负载金红石TiO2可高活性、高选择性催化CO2甲烷化反应, 而以锐钛矿TiO2做载体则几乎没有活性。负载型催化剂上金属颗粒尺寸也是影响催化剂活性的重要因素, Wu H等[30]制备了负载质量分数0.5%和10%的Ni/SiO2, 分别得到尺寸较小的Ni金属团簇和尺寸较大的Ni纳米颗粒, 在低负载量的Ni/SiO2催化剂上CO2加氢的主要产物为CO, 而在较高负载量的Ni/SiO2催化剂上主要产物为CH4。
CO2催化加氢制甲醇(公式3)是C1化学领域的研究热点[9, 40]。甲醇是一种优良的燃料, 也是一种重要的化工原材料。与汽油相比, 甲醇具有较高的辛烷值及更高的火焰速度, 使甲醇发动机具有更高效率。甲醇还可用于甲醇燃料电池(DMFC)中, 为手提电脑、手机和小型汽车等提供电力。甲醇可用于生产种类繁多的化工产品和材料, 如氧化制甲醛、脱水制二甲醚和羰基化制乙酸, 又如甲醇制烯烃(MTO)、甲醇生产汽油(MTG)以及作为合成各种高分子、油漆和塑料的前驱体。诺贝尔化学奖得主Olah G A[11]在20世纪90年代提出甲醇经济概念, 认为可以通过CO2加氢合成甲醇的路线对回收到的CO2进行化学利用, 既减少了CO2排放, 同时可以获得甲醇这一重要的能源及化工原料, 引发了社会的广泛讨论。
CO2 + 3H2 $\rightleftharpoons$CH3OH + H2O;
CO2加氢制甲醇为放热反应, 温度升高不利于甲醇生成。由于CO2难以活化, 加上热力学的不利因素, CO2加氢制甲醇转化率一直很低, 同时甲醇化反应伴随CO和CH4等副产物生成, 影响甲醇产率。因此, 研制高活性、高选择性和低成本催化剂是目前面临的挑战。
20世纪60年代, ICI公司发展了以Cu/ZnO为催化剂的合成气制甲醇工艺, Cu/ZnO催化剂成为CO2加氢合成甲醇反应工业催化剂的基础。目前工业上使用Cu/ZnO/Al2O3为催化剂, 在压力(5.07~10.13) MPa和温度(200~300) ℃将CO2转化为甲醇[11]。近三十年来, 国内外研究人员在催化剂组成[41]、制备方法[42, 43]、反应条件[44]及反应机理[45]等方面对铜基催化剂进行了大量改良和创新。Cu/Zn/Al/Zr[46]、Cu/Zn/Al/Mn[47]、Cu/Zn/Zr[41]和Cu/Zn/SiO2[44, 48]等催化剂被发现具有良好的活性。Bonura G等[41]采用不同制备方法制备Cu-Zn-Zr催化剂, 并对其影响催化剂活性的原因进行探讨。Larmier K等[49]研究了Cu-Zr催化过程的中间产物, 并对金属氧化物界面的反应机理进行讨论。Kattel S等[45]探讨了Cu/ZnO催化剂在CO2加氢反应中的活性中心, 并对反应机理进行探讨。除此以外, 还有研究向铜基催化剂中添加助剂进行优化[50], 对催化剂预处理方法进行优化[43]等。
铜基催化剂主要缺点是在高温下活性组分Cu会发生烧结[51], 使催化剂失活。贵金属基催化剂由于其高稳定性和抗烧结、抗中毒能力, 被提出作为Cu基催化剂的替代品。如Pd/SiO2[52]、Pd/Al2O3[53]、Pd/La2O3[54]和Li-Pd/SiO2[54]等, 他们能在更低温度和压力下转化CO2。但贵金属催化剂存在选择性低和成本高的问题, 而且由于其与CO2结合力较弱, 不能高效催化该反应, 也不能调控产物分布。部分其他催化剂也被发现具有较好的催化活性。Wang J等[55]发现ZnO-ZrO2固溶体催化剂在较高温度(320 ℃)下仍保持高CO2转化率和甲醇选择性, 并能在硫化物气氛下仍维持很好的稳定性。Rodriguez J A等[56]报道了Mo2C有良好的CO2加氢制甲醇活性。此外如Fe3C[57]、SnCl4[58]和Pd2Ga[59]等催化剂也被文献报道。
除此以外, 氧化铟(In2O3)是近年来被报道的一种极具前景的新型催化剂, 通过优化合成方式, (200~300) ℃达到接近100%甲醇选择性。特别是在高温下, In2O3仍能维持高甲醇选择性和产率[60], 在330 ℃和4 MPa条件下, 甲醇选择性达30%, 收率达2.82%[61]。In2O3在高温下优异的性能吸引了大量课题组的关注。In2O3催化剂虽然具有较高的甲醇选择性, 但由于CO2转化率较低, 导致其甲醇产率偏低。研究者目前采取一系列策略对In2O3催化剂进行优化和改进。主要策略有:(1) 将In2O3负载在其他氧化物载体上[60, 61, 62]; (2) 在In2O3体系中引入其他金属元素。将In2O3负载在其他氧化物载体上可以增加In2O3分散度, 增加催化剂中氧空穴含量, 增强吸附CO2的能力, 稳定关键的表面中间物种。将In2O3负载在ZrO2上是该策略的典型例子, 其可以极大地增强催化剂本征活性。在In2O3体系中引入其他金属元素可以增强H2解离吸附以及H2溢流的能力。文献中已经报道了在In2O3体系中引入Pd[63]、Pt[64]、Cu[65]、Rh[66]、Au[67]、Co[68]和Ni[69]等金属, 并取得了良好效果。
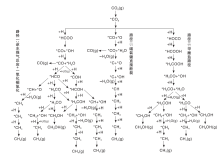
对于CO2加氢合成甲醇的反应机理, 研究者有诸多争论。CO2加氢制甲醇目前学术界通过原位表征和理论计算结合的方式确定了两条主要反应路径(图3)。第一条是甲酸盐路径, CO2首先在催化剂表面加氢生成甲酸盐中间物种(* HCOO, * 代表表面吸附的物种), 之后继续加氢转化为甲氧基中间物种(* HCO或* H2CO), 最后生成甲醇。CO2在Cu/ZnO和Cu/ZnO/Al2O3催化剂上以该路径生成甲醇[45, 70]。第二条路径是CO加氢路径, 即催化剂表面吸附的CO2先转化成羧基中间体(* HOCO), 羧酸中间体再通过RWGS反应生成CO, CO继续加氢生成甲醇。CO2在Cu/CeO2和Cu/CeO2/TiO2上以该种路径加氢[71]。
烃类化合物具有广泛的用途和重要的作用, 其中低碳烯烃(C2-C4)是合成药物、聚合物、洗涤剂以及溶剂等化工用品的原料, 高碳烃(C5+)是优质的液体燃料[73, 74, 75, 76]。烃类化合物可通过石油裂解或合成气费托合成的方式得到, 但目前石油资源日趋枯竭, 石油开采成本和价格居高不下, 制备烃类化合物的传统蒸气裂解原料短缺, 限制了化工行业的发展。我国的能源结构为多煤少油, 因此, 开发以非油为原料的新型工艺具有战略意义。费托合成[77, 78]是指以合成气(CO+H2)为原料在催化剂作用下合成烃类化合物的工艺技术, 反应符合烃池机理, 产物有低碳烯烃、长链烷烃、高级石蜡以及醇类醛类和有机酸。但费托合成的产物服从ASF(Anderson-Schulz-Flory)分布规律(如图4), 产品碳数分布宽, 特定产物选择性受限, C2-C4烃类选择性不超过58%, 芳烃选择性不超过15%。
 | 图4 F-T反应产物分布及烃池机理[78] A.通过ASF模拟的费托合成反应产物分布; B.典型的费托合成理论产物分布, α =0.70; C.费托合成反应的烃池机理模型[78]Figure 4 Product distribution and hydrocarbon pool mechanism of F-T reaction[78] |
将CO2作为碳源制备烃类化合物相比于上述两种反应路线更加环境友好。目前CO2加氢制烃类化合物主要有两种技术路线(如图5), 第一种是以CO作为中间体, 先将CO2转化成CO, 再利用CO进行费托合成生成烃类[76, 79]; 第二种是以甲醇作为中间体, 先由CO2生成甲醇, 再将甲醇转化为烃类化合物[73, 74, 76, 80]。这种将CO2直接加氢产物作为中间体进一步转化的催化剂称为双功能催化剂, 其通常由金属或金属氧化物与费托催化剂或分子筛耦合构成, 其中金属或金属氧化物将CO2转化为中间物种CO或CH3OH, 费托催化剂或分子筛将中间物种C-C偶联。由于两个不同反应在双功能催化剂上同时发生, 涉及到两种不同功能的催化活性位点, 需要对催化剂进行合理设计。
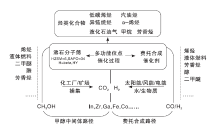 | 图5 CO2加氢合成高附加值烃类化合物的两种常规路径[78]Figure 5 Two conventional pathways for the synthesis of value-added hydrocarbon compounds by CO2hydrogenation[78] |
从热力学上分析, CO2转化为CO为吸热反应, 而转化为CH3OH为放热反应, 即高温有利于CO生成而不利于CH3OH生成。分子筛中进行的C-C偶联反应在动力学上需要340 ℃以上的高温, 在此温度下, 甲醇路线的产物中烃类产率较低, 而CO路线则可以很好的温度匹配。CO路线主要使用Fe基和Co基催化剂, 如Co/Si2[81]、Co-Pt/γ -Al2O3[82]、Fe/C[83]和ZnFe2O4[84]等。其产物分布和传统费托合成相似, 遵循ASF分布, 不利于实现对目标产品的高选择性。如图4[78]中, 在链增长速率0.7时, 液体燃料(C5+)选择性约53%, 低碳烃(
相比之下, 以甲醇为中间体的路线虽然有热力学的劣势, 但可以通过催化剂的设计实现对目标产品的高选择性。以甲醇为中间产物的双功能催化剂体系中, 催化CO2到甲醇部分的活性组分需要满足在高温300 ℃以上仍有较高的甲醇选择性。如以工业催化剂Cu/ZnO/Al2O3与SAPO-34分子筛耦合组成的双功能催化剂, 产物中没有C2-C4烃类[85], 而使用ZnZrOx或In2O3与SAPO-34耦合时, C2-C4在烃类化合物中的比例达70%以上[75]。原因是Cu/ZnO/Al2O3在高温下甲醇选择性极低, 300 ℃时仅为3.8%, 而ZnZrOx或In2O3即使在340 ℃高温下, 甲醇选择性仍约30%。该路线的金属氧化物-分子筛复合体系中, 金属氧化物可选用In2O3[74]、ZnO-ZrO2[75]和In2O3-ZrO2[73]等固溶体类氧化物以及ZnCrO4[80]、ZnAl2O4[86]和ZnGa2O4[86]等尖晶石结构化合物; 此外选用不同种类的分子筛可以调控产物选择性生成低碳烯烃[75]、芳烃[87]和汽油烃[76]等。
ZnZrOx-分子筛串联催化剂是目前被广泛研究的一种双功能催化剂。Wang J等[55]报道了固溶体双金属氧化物催化剂(ZnO-ZrO2), 可催化实现CO2高选择性、高稳定性合成甲醇, 在320 ℃高温下甲醇选择性仍约90%。基于ZnO-ZrO2固溶体催化剂体系, Li Z L等[75]设计了ZnO-ZrO2固溶体/Zn改性SAPO-34分子筛串联催化剂体系, 实现了CO2加氢直接制备低碳烯烃。ZnZrO/SAPO串联催化剂在接近工业生产的反应条件下[380 ℃, 2 MPa, 3 600 mL· (gcat· h)-1], CO2单程转化率为14%, 烃类中低碳烯烃选择性达80%~90%。Zhang X等[88]进一步构建了ZnZrO/ZSM-5串联催化剂体系, 成功实现CO2加氢高选择性转化为芳烃。ZnZrO/ZSM-5串联催化剂体系的协同作用, 使热力学有利的MTA反应拉动了热力学不利的CO2加氢制甲醇反应。在CO2单程转化率14%时, 烃类中芳烃选择性达73%~78%, CO选择性低至44%, CH4选择性低于0.3%。Zhou C等[89]报道了ZnO-ZrO2气凝胶和H-ZSM-5串联催化剂体系(ae-ZnO-ZrO2/H-ZSM-5), 实现CO2高选择性加氢制备芳烃。在CO2单程转化率为16%, 芳烃选择性高达76%, 芳烃时空收率STY达0.24(goxide· h)-1。
尖晶石结构金属氧化物-分子筛双功能催化剂是另一类被广泛研究的催化剂。Nie X等[90]设计了纳米尖晶石结构ZnAlOx氧化物和高硅铝比的纳米H-ZSM-5分子筛复合的ZnAlOx-H-ZSM-5串联催化剂, 在CO2加氢制芳烃反应中, 芳烃选择性达73.9%, 副产物甲烷选择性低至0.4%。经TEOS进一步处理后, ZnAlOx-Si-H-ZSM-5串联催化剂可进一步提高乙烯、丙烯和PX选择性。Liu X等[86]报道了尖晶石结构ZnAl2O4、ZnGa2O4和SAPO-34复合的双功能催化体系(ZnAl2O4/SAPO-34和ZnGa2O4/SAPO-34), 高效催化CO和CO2加氢制备低碳烯烃。ZnAl2O4/SAPO-34在CO2单程转化率为13%~15%下, 烃类中低碳烯烃选择性达86%~87%, CO选择性仅46%~49%。ZnGa2O4/SAPO-34在CO2单程转化率为24%~30%下, 烃类中低碳烯烃选择性达77%~80%, CO选择性仅41%~43%。
除此以外, In2O3-分子筛串联催化剂是另一种非常重要的催化剂体系。Gao P等[74]报道了In2O3/HZSM-5双功能催化剂催化CO2高选择性加氢到汽油馏分(C5-C11)碳氢化合物。CO2加氢烃类产物中以高辛烷值异构烃为主, 其中汽油馏分选择性达 80%, 而CH4仅有1%。In2O3表面的氧空穴活化CO2, CO2加氢生成甲醇, 甲醇继而在HZSM-5中遵循烃池机理(Hydrocarbon Pool), 发生C-C偶联反应, 生成以高辛烷值的异构烃为主的汽油馏分烃类化合物。Gao P等[73]还报道了In-Zr复合氧化物/SAPO-34双功能体系催化CO2高选择性加氢到低碳烯烃。CO2转化率约30%, 烃类产物中C2~C4选择性约93%, 其中低碳烯烃选择性约80%, 甲烷选择性约4%。In-Zr复合氧化物表面的氧空穴活化CO2, CO2加氢生成甲醇, 甲醇继而在SAPO-34分子筛CHA笼中发生C-C偶联反应, 生成低碳烯烃。
CO2催化加氢不仅可以减少温室气体的排放, 还可以将CO2转化为高附加值化学产品, 具有优良的应用前景。尤其是在2020年我国承诺CO2排放量在2030年前碳达峰, 2060前实现碳中和, 在此背景下发展CO2减排的技术尤为重要。选取一氧化碳、甲烷、甲醇及烃类化合物四种典型产物对CO2加氢过程的热力学行为、催化剂选取及研究进展进行简要综述, 希望使读者对CO2加氢有一个整体的认识, 并对今后CO2加氢的研究有所启示。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|