作者简介:李 博,1988年生,女,工程师,主要从事催化剂工艺研发。
主要研究1,8-二氮杂二环十一碳-7-烯(DBU)催化碳酸乙烯酯和甲醇酯交换反应合成碳酸二甲酯的反应动力学。首先假设碳酸二甲酯的反应机理,在此基础上建立动力学模型,得到相应的动力学方程。通过实验数据处理,线性回归计算得到动力学方程的未知参数,最终得到反应速率 r=4.288 9 e-15 763/RTcEC cMEOH-49 811 e-31 308/RTcDMC cEC /cMEOH,其中正反应活化能 E+a=15 763 J·mol-1,正反应指前因子 k+0=4.388 9,正反应速率常数 k+=4.388 9 e-15 763/RT;逆反应活化能 E-a=31 308 J·mol-1,逆反应指前因子 k-0=49 811,逆反应速率常数 k-=49 811e-31 308/RT。研究结果为模拟计算及工业化放大提供了一定的理论依据。
Kinetics of transesterification reaction of dimethyl carbonate synthesis from ethylene carbonate and methanol catalyzed by 1,8-Diazabicyclo[5.4.0]undec-7-ene (DBU) was studied in this article.Mechanism of this reaction was proposed firstly,then the kinetic model.Corresponding kinetic equation was deducted by linear regression of the experimental data:the reaction rate r=4.288 9 e-15 763/RTcEC cMEOH-49 811 e-31 308/RTcDMC cEC /cMEOH,where the activation energy of the positive reaction is E+a=15 763 J·mol-1,preexponential factor k+0=4.388 9, reaction rate constant k+=4.388 9 e-15 763/RT;the activation energy of the reverse reaction E-a=31 308 J·mol-1,preexponential factor k-0=498 11, reaction rate constant k-=498 11e-31 308/RT.The results of this paper provided a theoretical basis for modeling and industrial scale-up.
碳酸二甲酯(DMC)是一种清洁环保的化工原料, 无毒, 易降解, 可作为汽油添加剂[1], 作为溶剂添加进行油漆性能改进[2], 替代剧毒的硫酸二甲酯用于合成高附加值的下游产品, 如碳酸甲乙酯[3]、碳酸二乙酯[4]和碳酸二苯酯[5]等, 这些碳酸酯大多可作为锂电池的电解液[6]。碳酸二甲酯的生产方法主要有光气法、甲醇氧化羰基化法、酯交换法、甲醇尿素法和二氧化碳甲醇法等, 光气法已基本被淘汰, 尿素甲醇法[7]原料廉价易得, 具有发展潜力, 但工业化较少, 而酯交换法则是目前工业化使用最多的方法, 该法是以甲醇、环氧丙(乙)烷以及二氧化碳为原料, 在催化剂作用下, 环氧丙(乙)烷与二氧化碳反应先合成出碳酸丙(乙)烯酯, 随后碳酸丙(乙)烯酯再与甲醇进行酯交换反应得到碳酸二甲酯, 同时副产丙(乙)二醇。酯交换法由美国Texaco公司于1992年率先实现工业化试验, 因其反应条件温和、收率高和环境污染小等特点, 该法合成DMC装置产能合计约占DMC总产能的90%以上, 成为我国DMC生产的主流工艺。本文研究酯交换法合成碳酸二甲酯的反应动力学。
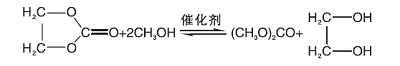
以1, 8-二氮杂二环十一碳-7-烯(DBU)催化碳酸乙烯酯(EC)与甲醇(MEOH)酯交换反应制碳酸二甲酯(DMC)联产乙二醇(EG)为例, 其主要反应方程式为:
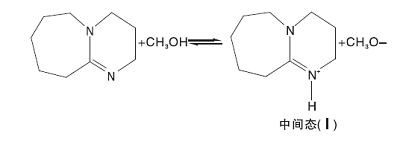
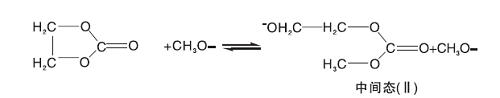
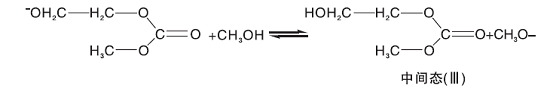
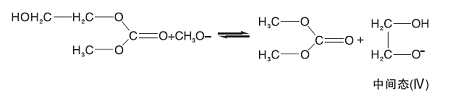
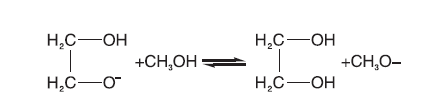
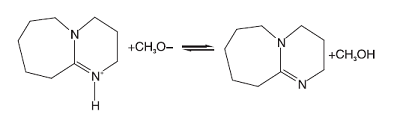
1, 8-二氮杂二环十一碳-7-烯(DBU)是一种均相催化剂。Bristow P A等[8]证明了中间体(中间态Ⅲ )羟乙基甲基碳酸酯(CH3OCOOCH2CH2OH)的存在, 因此假设DBU首先与甲醇发生质子交换[9], 然后甲氧基负离子再与碳酸乙烯酯反应开环, 开环产物继续与甲醇反应, 基元反应方程式为:
 |
 |
 |
 |
 |
 |
1.2.1 动力学模型假设[10]
(1) 由于中间态Ⅲ 的浓度很低, 从这点出发, 可以假设中间态Ⅲ 到碳酸二甲酯的过程(反应4)和生成二乙醇的反应(反应5)是快速反应过程, 两步反应平衡常数分别是Kp4和Kp5。而从中间态Ⅱ 与甲醇反应生成中间态Ⅲ (反应3)为慢反应, 也是整个反应过程的控制步骤, 碳酸乙烯酯与甲氧基反应生成中间态Ⅱ 的过程也假设为快速反应过程, 平衡常数为Kp2。
(2) 催化剂在反应条件下存在于液相中, 由于甲醇过量, 反应过程中液相体积变化很小, 可认为催化剂浓度不变化。
1.2.2 模型建立
由假定(1)得到反应的速率方程式为:
r=
根据1.1中反应方程式可推出反应(2)、(4)、(5)的平衡常数:
KP2=
KP4=
KP5=
综合(1-1)~(1-4)4个式子, 得到:
r=k'+KP2cECcMEOH
由假定(2), 认为催化剂浓度不变, 那么
令k+=k'+Kp2
r=k+cECcMEOH-k-cDMCcEG/cMEOH(1-6)
碳酸二甲酯联产乙二醇的反应总平衡常数为K, 其计算如下:
K=
通过方程式(1-6)和(1-7)联立, 已知平衡常数并计算出液相浓度, 通过阿伦尼乌斯方程k=k0e-Ea/RT, 得lnk=lnk0-Ea/RT, 建立lnk与温度倒数1/T的关系, 线性回归就能求出指前因子k0和反应活化能Ea的值, 从而解得动力学方程式。
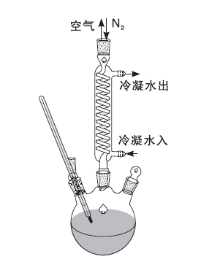
酯交换反应动力学实验在玻璃装置中进行, 反应器为三口烧瓶, 冰水浴或热水浴控制温度, 反应在N2氛围搅拌下进行。酯交换动力学研究装置如图1所示。
采用C-2000Ⅱ 型气相色谱仪, 配备N-2000色谱工作站或同性能的其他型号工作站与色谱数据处理机。色谱柱, Porapak-QS, 0.5 m× 3 mm, 对原料和产物组分进行分析和定量。汽化室温度280 ℃, 检测室温度120 ℃, 桥流120 mA, 载气H2, 流速30 mL· min-1, 进样量2 μ L。采用程序升温对原料和产物组分进行分析和定量。气相色谱程序升温参数为:初始温度150 ℃, 初时5 min, 温升速率15 ℃· min-1, 最终温度240 ℃, 终时15 min。
采用校正峰面积外标法对各组分进行校正。将碳酸乙烯酯、甲醇、碳酸二甲酯、乙二醇、二甘醇和乙二醇单甲醚中几种配置不同比例的混合标准液, 用于校正因子测试分析。校正因子的计算过程为:
组分i的校正因子:Fi=
其中, Fi为组分i的校正因子; Xi为标样中组分i的含量; Ai为标样中组分i的峰面积。
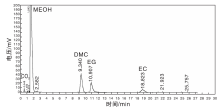
图2为酯交换反应产物的气相色谱图。
实验步骤:称量碳酸乙烯酯和甲醇(物质的量比1:10)加入到三颈烧瓶中; 将三颈烧瓶在水浴中达到设定温度后, 加入DBU, 此时记作反应开始; 达到反应设定反应时刻后, 取样并用气相色谱分析反应混合物, 计算混合物中各组分浓度。由于本反应即使在不加催化剂情况下, 也有产物生成, 因此在每个反应温度都做了空白实验, 作为实验零点扣除。空白实验步骤:称量碳酸乙烯酯和甲醇(物质的量比1:10)加入到三颈烧瓶中; 将三颈烧瓶在水浴中达到设定温度; 取样并用气相色谱分析反应混合物, 计算混合物中各组分浓度。
采用修正的Rackett方程[11]计算零时和各温度反应后的液体摩尔体积。
修正的rackett方程为:
V=
T=T/TC(2-2)
Tr≤ 0.75时, τ =1+(1-T/TC)2/7,
Tr≥ 0.75时, τ =1.60+6.930 26× 10-3(Tr-0.655)-1。
对于混合液体, 混合规则是:
zram=
Tcm=
式中, xi为组分i物质的量分数; Zra为拉凯特常数, 是对临界压缩因子的修正。
各组分的临界参数及拉凯特常数如表1所示。
| 表1 各组分临界参数及拉凯特常数 Table 1 Critical parameters and Lakette constant of components |
根据计算得到摩尔体积Vi, 可以计算混合物各组分的体积摩尔浓度ci:
ci=
根据1.5步骤, 在投料MeOH与EC物质的量比为10:1和催化剂摩尔浓度0.14%时, 进行不同温度的酯交换反应, 并在反应不同时间段取样测量碳酸乙烯酯转化率, 如表2所示。编号1、4、7和10为对照空白组, 无催化剂添加, 其数据反映了在配料、搅拌过程中碳酸乙烯酯与甲醇发生酯化反应的速率, 作为反应零时数据。
| 表2 不同温度下的碳酸乙烯酯转化率数据 Table 2 Conversion data of ethylene carbonate at different temperatures |
根据 Van’ t Hoff方程, 平衡常数K与温度的关系为:
[
式中, Δ H0为标准反应热。如果温度变化不大, Δ H0可近似为常数, 将上式积分得:
lnK=
根据Fang Yunjin等[10]研究得到的碳酸乙烯酯和甲醇均相酯交换反应过程的平衡常数和温度倒数的关系:
lnK=1 869.4/T-9.3362(2-9)
计算得到反应热Δ H0=-15.543 kJ· mol-1, 与文献报道的-14.3 kJ· mol-1比较吻合, 因此采用该关系式计算平衡常数。在反应温度277.15 K、299.15 K、316.15 K和333.15 K时, 平衡常数K分别为0.074 94、0.045 63、0.032 61和0.024 11。
不同温度和反应时间所对应的混合液各组分的物质的量分数如表3所示。
| 表3 混合液各组分物质的量分数 Table 3 Mole fraction of the components of the mixture |
由前述修正的Rackett方程计算混合液摩尔体积, 计算结果如表4所示, 根据表3和表4数据由式(2-6)计算便可得到产物体积摩尔浓度, 如表5所示。
| 表4 混合液摩尔体积 Table 4 Mole volumn of the mixture |
| 表5 产物体积摩尔浓度 Table 5 Calculation of product volume molar concentration |
根据求出的碳酸乙烯酯摩尔浓度, 计算得到不同温度、不同反应时间的平均反应速率(rEC)作为反应速率r, 再由方程式(1-6)、(1-7)及2.2节求得的平衡常数K代入, 可求得正、逆反应的反应速率常数k+和k-, 如表6~7所示。
| 表6 动力学参数计算Ⅰ Table 6 Calculation of kinetic parametersⅠ |
| 表7 动力学参数计算Ⅱ Table 7 Calculation of kinetic parameters Ⅱ |
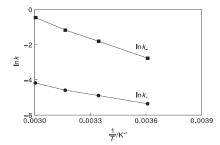
按表6~7数据作图, 进行线性回归, 建立lnk与温度倒数1/T的关系, 如图3所示。
线性回归得到lnk+与1/T的关系式为:
lnk+=1.479 1-1 896/T(2-10)
方差R2=0.990, 数据线性拟合较好, 由(2-10)斜率可以求得正反应的活化能, 截距可求得正反应指前因子, 得到正反应速率常数的计算式为:
k+=k+0e-E+a/RT=4.388 9e-15 763/RT(2-11)
逆反应lnk-与1/T的关系式为:
lnk-=10.816-3 765.7/T(2-12)
方差R2=0.997, 数据线性拟合较好, 由(2-12)斜率可以求得逆反应的活化能, 截距可求得逆反应指前因子, 得到逆反应速率常数的计算式为:
k-=k-0e-E-a/RT=49 811e-31 308/RT(2-13)
将上述计算结果代入(1-6)中得到碳酸乙烯酯和甲醇酯交换反应的速率:
r=4.388 9e-15 763/RTcECcMEOH-49 811e-31 308/RTcDMCcEG/cMEOH(2-14)
根据假定的1, 8-二氮杂二环十一碳-7-烯(DBU)催化碳酸乙烯酯和甲醇酯交换生成碳酸二甲酯的反应机理, 在此基础上建立了动力学模型, 得到了相应的动力学方程。通过实验数据处理, 回归计算Arrhenius方程的未知参数, 最终得到反应速率r=4.388 9e-15 763/RTcECcMEOH-49 811e-31 308/RTcDMCcEG/cMEOH, 其中, 正反应活化能E+a=15 763 J· mol-1, 正反应指前因子k+0=4.388 9, 正反应速率常数k+=4.388 9e-15 763/RT; 逆反应活化能E-a=31 308 J· mol-1, 逆反应指前因子k-0=49 811, 逆反应速率常数
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|