作者简介:曹琪岩,1995年生,女,在读硕士研究生,研究方向为纳米催化剂及反应。
甲醇是重要的化工基础原料,在双功能催化剂的作用下,甲醇选择氧化可以制取高附加值的甲酸甲酯下游产品。本文对近年来甲醇选择氧化制甲酸甲酯的催化剂体系、反应工艺、反应机理等方面的研究进展进行了归纳、总结和评述,特别是贵金属及其合金催化剂表面活性氧物种对甲醇的选择氧化机理、金属结构和纳米颗粒尺寸与O2的吸附解离关系、金属间电子转移增强及避免甲醇深度氧化等方面的影响进行了深入的分析,并对甲醇选择氧化双功能催化剂的发展趋势进行了展望。
As an important chemical basic raw material,methanol can be converted to high value-added products,such as methyl formate,by selective oxidation using the dual-function catalysts.In this paper,the recent research progress on selective oxidation of methanol to methyl formate was summarized and reviewed,including catalyst system,reaction process and reaction mechanism.In particular,the effects of the active oxygen species on the surface of noble metal and its alloy catalysts on the selective oxidation mechanism of methanol,the relationship between metal structure and nanoparticle size and the adsorption and dissociation of O2,the enhancement of electron transfer between metals,and the avoidance of methanol deep oxidation were deeply analyzed.Furthermore,the development trend of dual-functional catalysts for selective oxidation of methanol was prospected.
甲醇是一种重要的有机化工基本材料, 在工业上广泛应用。我国是世界甲醇主产国之一, 我国的甲醇生产以煤制甲醇工艺为主, 产能占比高达76%[1]。随着煤制甲醇工业的发展, 甲醇产量逐年增长, 2019年我国甲醇产量达到约62.16 Mt, 同比增长11.5%。甲醇产能过剩的问题也促进了甲醇下游产品的研究和开发。目前甲醇下游产品的工业生产, 主要包括甲醇银法和铁钼法氧化制甲醛[2]、甲醇羰基化法制醋酸[3]、MTO/MTP技术制烯烃[4]等, 随着甲醇产能的逐渐过剩以及甲醛、醋酸等产品的需求量有限, 开发更加多样化的下游产品, 拓展甲醇下游产品的需求领域成为科学研究和工业开发的重要内容。甲酸甲酯(HCOOCH3, MF)是甲醇的高附加值下游产品之一, 同时也是C1化学中重要的有机合成中间体, 主要用于合成甲酸, 乙二醇, 汽油添加剂以及酰胺类产品等, 被广泛应用于造纸、材料、溶剂、食品等行业, 新型甲醇氧化制甲酸甲酯工艺的开发能够拓宽甲醇下游市场, 具有极大的研究价值和工业发展潜力。
目前国内甲酸甲酯的合成工艺主要有[5]:甲酸酯化法、甲醇羰基化法、甲醇脱氢法等。甲酸酯化法直接通过甲酸与甲醇的酯化反应制甲酸甲酯, 是工业上最早采用的生产方法, 此方法工艺简单, 但产品消耗量大, 且设备腐蚀严重, 生产成本高[5, 6]。甲醇羰基化法是目前合成甲酸甲酯的主要工业生产方法, 此方法中使用的催化剂甲醇钠对杂质敏感, 易与H2O、CO2、O2等杂质反应, 造成堵塞, 因此对原料要求苛刻, 且产物与催化剂不易分离, 原料及产物的分离纯化以及催化剂消耗的成本高[7, 8]。甲醇脱氢法是在铜基催化剂及其他金属氧化物催化剂上脱氢生成甲酸甲酯[7], 该工艺自20世纪20年代提出以来就被广泛应用于甲酸甲酯工业生产中, 工艺流程简单, 但反应能耗高且受热力学平衡制约。甲醇选择性氧化制甲酸甲酯以甲醇和氧气作为反应物, 利用双功能催化剂的氧化性和酸性进行甲醇的部分氧化和酯化, 是一种新型甲醇制备甲酸甲酯的方法, 反应不受平衡限制且原子利用率高, 具有绿色节能的优点和更为广泛的应用前景。目前甲醇选择氧化制备甲酸甲酯使用的双功能催化剂主要分为Pt、Au、Pd和双金属催化剂等贵金属催化剂体系以及金属氧化物催化剂体系两大类, 研究人员对催化反应的机理以及提高双功能催化剂的转化率和选择性进行了探究。
本文对近年来甲醇选择氧化制甲酸甲酯反应中的催化剂体系、催化反应条件、催化反应机理等方面的研究进展进行了总结和评述, 并对甲醇氧化双功能催化剂未来的发展方向进行展望。
在贵金属催化剂体系中, 甲醇在裸露的金属表面上的吸附性能较弱, 贵金属表面预吸附的原子氧能够促进CH3OH发生O-H键的断裂, 形成甲氧基与羟基物种, 甲氧基物种与贵金属表面活性位点上的活性氧物种反应发生氧化解离, 实现了甲醇的氧化以及甲酸甲酯的选择性制备。贵金属催化剂催化甲醇氧化制甲酸甲酯常用的有Pt、Au、Pd等贵金属催化剂以及双金属催化剂。
Pt催化剂在低温下具有高活性。甲醇在Pt催化剂表面发生氧化脱氢反应时, 首先在金属位点上发生O-H键的断裂, 得到吸附的甲氧基, 甲氧基上的C-H键逐个活化脱氢生成氧化反应中间体甲醛, 再与CH3OH发生二次反应生成其他选择性氧化产物[6, 9]。Tu W等[10]通过实验发现甲醇氧化反应中, 在较低的O2/CH3OH比率(< 0.5)下, 甲醇氧化产物都是直接由CH3OH直接生成的。随着O2/CH3OH比率的增加, CH3OH首先在Pt团簇表面的O*位点上解离成甲氧基(CH3O*), CH3O*逐步脱氢生成中间体HCHO, 再由氧化反应的中间体HCHO进一步氧化生成甲酸甲酯和CO2, 实验结果表明Pt基催化剂上HCHO产生速率和甲酸甲酯的生成速率与O2/CH3OH比率正相关。此外金属Pt催化剂的催化活性还与Pt团簇的大小以及Pt的价态有关[10, 11]。金属Pt在载体表面形成的Pt团簇直径影响着催化剂表面的活性氧(O*)和甲氧基的吸附性, 较大的Pt团簇与O*以及CH3OH氧化中间体的结合较弱, 因此反应速率更快、选择性更好, 其催化效率与小粒径的Pt团簇相比更高。Merte L R等[11]通过用胶束封装法制备了具有确定尺寸的Pt纳米催化剂, 并将其负载在γ -Al2O3载体上, 考察了氧化和还原预处理对Pt/γ -Al2O3催化剂活性和选择性的影响。测量显示预氧化后的催化剂中Pt-O键明显增加, 催化剂活性随其氧化程度增大逐渐增强。随着温度升高, 预还原处理后的催化剂中Pt-O键含量逐渐增多, 甲醇转化率也逐渐升高。由此推断Pt/γ -Al2O3催化剂上甲醇氧化过程可能与金属氧化物催化剂相似, 甲醇分子先与晶格氧反应, 再通过反应物O2补充晶格氧。实验表明氧化态的PtOx中主要由+2价的Pt组成, 对于低温下伯醇的氧化具有优越的催化效果。此外金梅梅等[12]对Pt/TiO2催化剂进行了表征, 发现Pt/TiO2催化剂载体形态差异也会导致催化活性的不同, 在TiO2纳米管阵列(TNTAs)和TiO2纳米线阵列(TNWAs)两种载体上, Pt/TNTAs催化剂载体TANAs具有更高的比表面积, 负载在TANAs上的Pt纳米颗粒也具有更高的催化活性, 甲醇氧化催化活性和稳定性要优于Pt/TNWAs。Pt催化剂反应机理复杂, 其催化活性与金属Pt价态、Pt团簇粒径及载体结构等有关。目前针对Pt催化甲醇氧化制甲酸甲酯的研究较少, 但Pt催化剂具有高活性和高转化率, 探究提高甲酸甲酯选择性是未来极具价值的发展方向。
金属Au催化剂能够在低温下以高选择性催化氧化反应, 但由于体相Au表面的O2难以发生吸附和解离, 因此不具备催化甲醇选择性氧化的性能。Tenney S A等[13]探究发现将Au纳米颗粒负载在TiO2上能够获得促进甲醇氧化的Au/TiO2催化剂。实验将Au纳米颗粒气相沉积在载体TiO2的表面, Au与载体中的氧空位缺陷稳定结合, 均匀分散形成Au-TiO2界面。催化剂载体材料TiO2中的表面晶格氧能够促进甲醇分子的O-H键断裂, 在Au-TiO2界面的活性位点上形成表面甲氧基, 随后催化剂表面的Au位点促进了甲氧基上C-H键断裂和H的解吸形成HCHO, Au-TiO2界面的形成降低了反应温度, 提高了反应的催化效率, 研究还发现甲氧基在Au/TiO2表面相较其他金属表面具有更高的热稳定性。
关于贵金属Au催化剂的研究主要针对Au-Ag进行脱合金处理制备的纳米多孔Au催化剂进行, 这是一种更为稳定易得的新型催化剂, 纳米多孔Au材料脱合金制备过程残留的少量Ag颗粒, 在O2活化过程中有重要作用。
低温下O2可在金属Ag表面发生吸附和解离, O2在Ag位点上活化生成多种活性氧物种[14], 极大提高了O2在催化剂表面的吸附量, 改善了O2在Au表面难以吸附和解离的问题。Yang Z等[15]发现改变反应温度会影响表面氧物种在Ag上的分布, 不同表面氧物种催化作用下甲醇氧化产物也不相同。反应温度较高时甲醇氧化产物主要是甲醛, 反应温度降低至(450~700) K时, Ag表面主要是吸附的原子氧物种(Oα )与亚表面氧物种(Oγ ), 此时甲醇与Oα 发生吸附解离形成甲氧基和表面羟基, 甲氧基与Oα 反应生成甲酸, 然后与邻位吸附的甲氧基缩合形成甲酸甲酯。
纳米多孔Au表面的活性氧原子促进了CH3OH解离吸附[16, 17]。反应过程中催化剂表面吸附的O*促进CH3OH解离吸附生成CH3O*, CH3O*亲核攻击HCHO*中的羰基碳, 形成表面半缩醛中间体, 随后发生β-H消除生成HCOOCH3, 如式1~式3所示[18]:
O*+CH3OH→ CH3O*+OH* (式1)
CH3O*+HCHO*→ HC(H)(O)OCH3 (式2)
HC(H)(O)OCH3+O*→ HC(=O)OCH3+H2O(式3)
Wittstock A等[19]最先通过刻蚀Au-Ag合金中的Ag, 制备出了能够高效催化甲醇选择性氧化制甲酸甲酯的纳米多孔Au催化剂, 纯纳米多孔Au材料具有强催化氧化活性。甲醇氧化反应的转化率达到60%, 甲酸甲酯选择性达到97%。但纯纳米多孔Au材料的高成本不利于其工业推广, 因此Zhang Q等[17]利用薄片铝纤维材料孔隙率大的特点, 通过AuAg与Al间的离子交换将AuAg逐步电沉积到载体铝纤维上, 然后在HNO3溶液中浸出Ag, 制备出了高比表面积的NPG/Al-fiber催化剂, 这种催化剂催化活性强、导热性和稳定性好, 且具有低成本及功能性强的优点。反应在170 ℃时得到了约45%的转化率和约85%的甲酸甲酯选择性, 实验结果表明催化剂中残余的Ag含量变化可能会对表面氧物种形成产生影响, 从而改变甲酸甲酯的选择性。因此在后续研究中Zhang Q等[20]又通过将Au-Ag合金逐步沉积的方法探究了Ag含量对1Au-xAg/Al-fiber体系催化效果的影响, 实验证明Ag含量变化对催化性能的影响主要体现在对甲醇转化率的影响上, 过量Ag在载体表面团聚, 减少了纳米Au颗粒与载体的结合, 使得Au与甲醇结合位点减少, 降低了甲醇转化率, 但Ag含量对甲酸甲酯的选择性没有显著影响。NPG/Al-fiber体系中1Au-0.2Ag/Al-fiber催化剂中Ag含量更低, Ag纳米颗粒分散性好, 活性氧的吸附量大, 催化效果最佳, 其甲醇转化率达到51%, 甲酸甲酯选择性71%。
TiO2具有优良的光催化效果, 常被用作光催化反应的催化剂或催化剂载体。Kominami H等[21]以TiO2作为催化剂, 在紫外光下进行了甲醇催化氧化反应, 由于TiO2上通常发生的是完全氧化反应, 因此通过采用流动型反应器来避免甲醇的深度氧化从而获得产物甲酸甲酯, 在(298~523) K温度下甲酸甲酯选择性高达90%。Yang X等[22]发现负载TiO2表面的纳米Ag催化剂也具有一定的光催化性能, 能够在Ag-TiO2界面上形成肖特基势垒, 光生电子转移金属Ag上促进O2的解离和甲醇在TiO2空位上的氧化。Han C等[23]利用金属Au和Ag良好的导电性和光催化性能, 采用负载Au-Ag合金纳米颗粒的方式对光催化剂TiO2进行改性, 制备了Au-Ag/TiO2催化剂。金属Au-Ag与TiO2间形成肖特基势垒, 光生电子跃迁到金属上使得金属呈负电性, 从而促进游离的O2在金属表面的解离, 生成活性氧原子, 界面周围的正电荷则促进了甲醇在催化剂表面吸附解离成甲氧基, 甲醇中O-H键上的氢与表面羟基结合形成水, 金属颗粒表面上的活性氧随即补充TiO2表面上的氧空位, 甲氧基逐步脱氢并与晶格氧反应形成表面羟基和甲醛, 吸附的甲醛与甲氧基反应生成甲酸甲酯(反应过程如图1)。在(15~45) ℃温度范围内的紫外线照射下, 该反应甲醇转化率高于90%, 甲酸甲酯的选择性高于85%。
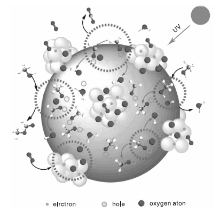 | 图1 Au-Ag/TiO2上甲醇选择性氧化为甲酸甲酯的反应机理[23]Figure 1 Reaction mechanism of methanol selective oxidation to methyl formate on Au-Ag/TiO2 |
纳米Au催化剂在甲醇选择氧化制甲酸甲酯反应中具有高选择性, 采用光催化方法能够明显提高纳米多孔Au催化剂的反应活性和转化率, 具有良好的工业应用前景。
相较以上几种催化剂, 负载Pd催化剂成本相对较低、催化活性高, 最近几年对负载型Pd纳米粒子催化性能的探究在甲醇选择性氧化领域备受关注。与Pt/γ -Al2O3催化剂经预氧化后催化性能有所提高相反[12], 被还原的Pd催化剂与氧化态的PdO催化剂相比, 明显具有更高的甲醇氧化转化率和甲酸甲酯选择性。Lichtenberger J等[24]利用H2还原后的Pd催化剂催化甲醇氧化反应, 发现在较低温度下反应速率极快, 且具有较高的甲酸甲酯选择性(甲酸甲酯选择性达到90%), 这是由于O2通过在Pd表面位点上吸附解离成能够氧化甲醇的活性氧原子, 而氧化态的PdO催化剂在反应初期需要先从PdO中提取晶格氧, 将其还原为Pd金属团簇造成的。研究发现在Pd/Al2O3中, Pd金属团簇被Al2O3中的氧空位缺陷固定在载体表面上, 从而获得高分散度, 效果稳定的催化剂。Pd团簇尺寸较小时金属团簇的分散度高, 载体表面氧空位少, Pd原子的配位不饱和度更高, 此时表面氧与较小团簇中Pd原子的结合能更强, 活性氧物种难以与甲醇反应脱附, 甲醇的反应速率和转化率也随之显著下降。
纳米颗粒由于具有良好的化学和物理性质, 能够提高金属催化剂的反应性能受到广泛关注, 金属Pd纳米颗粒对甲醇氧化反应的影响与Pd纳米颗粒和载体的性质密切相关, 催化剂活性和选择性与纳米颗粒的大小相关。纳米Pd催化剂制备过程中, Pd首先在液滴内部成核, 逐渐聚集成最终的Pd纳米颗粒, 在这一过程中加入表面活性剂, 能够控制颗粒的生长速度, 减慢Pd纳米核的生长速率, 从而形成粒径小且均匀的金属颗粒[25, 26]。表面活性剂改性的负载Pd纳米颗粒催化剂在载体的表面分散度高, 催化甲醇氧化的性能更好。Wojcieszak R等[26]采用微乳液法(肼作还原剂)制得的纳米Pd催化剂Pd/TiO2, 在催化甲醇选择氧化实验中甲醇转化率为76%, 甲酸甲酯选择性达到64%。通过调整Pd/TiO2的制备方法发现, 选用不同的表面活性剂改变水/表面活性剂物质的量比能够得到不同的纳米Pd颗粒尺寸。甲醇在Pd颗粒表面吸附脱氢形成甲氧基, 甲氧基逐步脱氢得到反应中间体HCHO, 由于催化剂上残留的肼具有一定的酸性, 能够催化HCHO与气态的甲醇分子缩合后脱氢直接生成甲酸甲酯[27], 因此低温(< 50 ℃)下具有90%~100%的高选择性。Pd纳米颗粒的粒径越大, 肼的吸附量越高, 酸性越高, 催化剂对甲酸甲酯的选择性也更大。此后Wojcieszak R等[27]又合成了负载在TiO2和SiO2(2%)上的两种负载Pd纳米颗粒催化剂, 其中Pd/SiO2催化剂在温度80 ℃下, 甲醇转化率达到88%, 甲酸甲酯选择性72%。Wojcieszak R等[28]通过改变Fe2+:Fe3+的比例制得了不同比表面积的Pd/γ -Fe2O3催化剂, 实验观察到Fe2+:Fe3+比例为1:2的样品在被肼还原后具有远高于还原前的比表面积, 证明肼还原能够改变氧化物的结构从而制得比表面积更大的γ -Fe2O3载体, 比表面积越大的催化剂催化活性越高。此时Pd/γ -Fe2O3催化剂在低温[(50~80)℃]下选择性最高, 达到了约88%, 表现出优异的催化甲醇氧化反应性能。低温和微乳液法比传统高温煅烧制备催化剂的方法更有利于形成粒径小的Pd颗粒且增加分散性, 同时甲醇在Pd颗粒表面吸附脱氢形成Pd-O键以及吸附的甲氧基, 催化剂表面位点与活性氧形成的弱酸性和碱性两性位点有利于甲氧基逐步脱氢并顺利解析得到反应中间体HCHO, 并与甲醇盐缩合反应产生甲酸甲酯。
金属有机框架(MOFs)是一种通过无机盐和有机配体在一定条件下形成的具有一定骨架结构的新型多孔材料, 由于其高孔隙率, 比表面积大, 活性中心复杂多样而被广泛用于非均相催化领域。覃荣现等[29]对比了γ -Al2O3、ZrO2、Bentonite(膨润土)、MIL-53(Al)和MIL-53(Fe)负载Pd催化剂对甲醇氧化的催化效果, 其中Bentonite(膨润土)、MIL-53(Al)和MIL-53(Fe)载体上的活性位点更强, 甲酸甲酯选择性更高。Liu J F等[30]制备的Pd/MIL-53(Al)多相双功能催化剂能够催化液相甲醇氧化制甲酸甲酯, 由于MOFs的多孔结构和MOFs上的多种活性中心, 可以将金属Pd纳米颗粒很好的分散并负载在MOFs材料上, 同时利用活性中心提供的酸性位点促进反应物的氧化和缩合, 甲醇在Pd颗粒表面发生O-H键断裂, 形成Pd-O键以及吸附的甲氧基, 甲氧基上发生β-H消除生成HCHO, 脱除的H则与Pd粒子上吸附的活性氧生成H2O, 并与HCHO反应脱氢产生甲酸, 甲酸在Lewis酸位上与甲醇分子缩合生成甲酸甲酯(反应机理如图2)。催化反应中甲醇转化率达60.3%, 甲酸甲酯选择性达62.2%, 相比气相氧化反应降低了能耗, 催化剂稳定性和重复使用性更好。
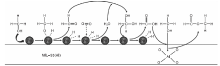 | 图2 Pd/MIL-53(Al)上甲醇选择性氧化为甲酸甲酯的反应机理[30]Figure 2 Reaction mechanism of methanol selective oxidation to methyl formate on Pd/MIL-53(Al) |
负载Pd催化剂的催化效果取决于金属含量、颗粒大小和载体等方面, 制备粒径可控的纳米Pd催化剂, 开发MOFs等高比表面积和活性位点丰富的载体, 进一步提升Pd催化剂的反应活性是未来的发展方向。
Au、Pd等贵金属制成的双金属催化剂具有很高的催化反应活性, 制备过程中两种金属能够在载体上形成合金颗粒, 利用氧化反应时合金颗粒中金属间的电子转移, 可以提高氧化反应速率和催化效果, 合金颗粒较单金属颗粒具有较大的直径以及更高的催化活性。Shi D等[31]通过溶胶固定法制备了1%Au-1%Pd/TiO2催化剂, AuPd金属粒子在载体TiO2上高度分散, 形成了核-壳结构的AuPd合金纳米颗粒。在催化甲醇氧化反应中, Pd纳米颗粒为Au纳米粒子提供电子, 促进 Au表面位点与游离的O2反应, 使得O2解离产生表面活性氧。Pd失电子后具有正电性, 能够促进表面甲氧基物种脱氢发生亲核反应成酯, 从而提高反应效率, 甲醇转化率达到55.7%, 甲酸甲酯选择性达74.2%。溶胶法制备Au-Pd双金属纳米催化剂时, 在合成胶体过程中加入稳定配体可控制纳米颗粒的粒径, 将预成型的粒径均匀的金属颗粒固定在载体表面上可获得高催化性能的纳米颗粒催化剂。但配体残留在催化剂表面会阻塞活性位点, 降低催化效果, 常见的热处理法去除配体时, 高温煅烧易导致催化剂表面金属颗粒团聚。Whiting G T等[32]对比了溶剂水萃取和传统热处理两种方法去除配体的Au-Pd/TiO2催化剂反应性能, 采用溶剂水萃取处理后的催化剂尽管表面残留的PVA含量更高, 仍存在配体堵塞活性位点的缺陷, 但低温处理没有破坏纳米粒子的粒径分布, 在30℃时实现了25%的甲醇转化率和60%的甲酸甲酯选择性。证明溶剂水萃取更能够保持金属纳米颗粒的尺寸稳定, 实现催化反应的高活性。
合金颗粒由于具有良好的金属间电子转移, 因此在载体上的结合能与单金属颗粒相比更低, 有利于反应中间体和产物的脱附以及提高表面活性位点的利用效率, 能够提高反应速率和产物选择性。由于贵金属Au、Pd催化剂原料成本高, 因此需要尽可能探索研究低贵金属负载量的催化剂降低制造成本, 增强其实用性, 促进工业应用的推广。Wu J B等[33]制备了Au+Pd负载量仅为0.6%的Au2-Pd1/SiO2催化剂。在130 ℃下, 甲醇转化率达到57.0%, 甲酸甲酯选择性为72.7%, 表现出优异的催化性能。Shan J等[34]通过电流置换法将催化活性高的金属Pd嵌入到金属Cu, 制备了PdCu单原子合金催化剂(PdCuSAA)。Pd原子在甲醇氧化反应后被局部氧化, 形成孤立的Pd阳离子。分散在Cu表面的PdO是甲醇氧化和甲酸甲酯生成的重要活性位点, 在160℃下, 甲酸甲酯选择性可达92%, 收率达到60%。
除了利用双金属合金颗粒内部的电子转移提高催化效率外, 使用导电性优异的石墨烯(Gr)材料作为载体, 也能够增强催化剂中的电子转移。同时石墨烯较大的比表面积、特殊结构和优异的导热性能, 能够为双金属纳米颗粒提供丰富的活性位点和优良的散热效果, 从而提高甲醇氧化反应效率。Wang R等[35]通过沉积-沉淀法将Au-Pd双金属纳米粒子负载在石墨烯上制备出精细分散且均匀的Au2.0-Pd1.0/石墨烯催化剂。石墨烯优良的导电性促进了Au-Pd合金中电子转移, 同时石墨烯中的π 电子转移到缺电子的Pd位点, 促进了PdO的还原, 增强了催化剂的催化效果。在70 ℃时甲醇转化率为90.2%, 甲酸甲酯选择性为100%。此后Wang R等[36]将碳纳米管(CNT)掺杂在石墨烯中对载体进行改良, 制备了Au-Pd/Gr-CNT催化剂。利用CNT作为间隔物插入层状的石墨烯片中, 抑制石墨烯成型过程中石墨片的面聚集, 增大载体材料的比表面积, 并能够充当电子转移的桥梁提高石墨烯材料的导电性, 从而促进PdO还原为Pd, 提高了低温下甲醇氧化反应速率和甲酸甲酯选择性。双金属催化剂利用金属间电子转移提高了反应活性, 采用石墨烯等具有特殊电子结构的材料作为载体是提升催化剂反应活性的重要方法和未来的研究方向。
甲醇选择性氧化制甲酸甲酯研究的部分贵金属催化剂性能对比见表1。
| 表1 贵金属催化剂催化氧化甲醇为甲酸甲酯性能 Table 1 Precious metal catalysts for methanol oxidation to methyl formate |
在金属氧化物催化剂体系中, 氧化物中的晶格氧与甲醇发生反应, 产生的氧空位被游离的O2补充。Ai M等[37]提出了CH3OH在同时具有酸性位及碱性位的双功能金属氧化物催化剂上, 先被氧化生成HCHO, 而后两个HCHO分子发生Tishchenko反应, 生成甲酸甲酯的催化反应机理。
V-Ti-O复合金属氧化物催化剂具有催化甲醇选择氧化生成甲酸甲酯的效果[38, 39]。研究表明, VOx在TiO2表面上沉积形成稳定的V4O6四聚体, V4O6纳米团簇可以在低温(300 K)下将甲醇选择性氧化为甲醛[40]。Kaichev V V等[41]实验证明甲醇在V2O5/TiO2催化剂表面Vn+位点上发生的选择性氧化反应遵循Mars-van Krevelen机理, 甲醇在催化剂中的V5+位上吸附解离形成甲氧基物种, 甲氧基氧化解离的H原子与分散在TiO2表面的VOx物种形成的V=O键和V-O-Ti中的O结合产生氧空位并生成HCHO分子, 其与气态CH3OH分子在约150 ℃下生成甲酸甲酯, O2分子在催化剂表面转变为晶格O2-物种, 将催化剂中V3+和V4+重新氧化为V5+, 实现催化剂再生, 如图3所示。该反应甲酸甲酯选择性在(140~150) ℃最高可达到85%。此后Li N等[42]又通过计算发现在V2O5/TiO2催化剂制备过程中添加硫酸盐促进剂能够增强Vn+位点的正电性, 降低甲氧基物种氧化脱氢的能垒, 由此提高V2O5/TiO2催化剂对甲醇氧化转化的催化活性以及甲酸甲酯选择性。Liu Z等[43]合成的氧化钒-二氧化钛-硫酸盐(VTS)催化剂在145 ℃下, 催化甲醇氧化的转化率和甲酸甲酯选择性均高达约97%。VOx催化剂相较贵金属催化剂降低了成本, 且具有较高的选择性, 通过硫酸盐改性能够明显提升催化剂转化率, 为VOx催化剂改性提供了突破性思路。
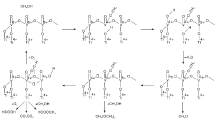 | 图3 TiO2负载的高分散性钒氧化物催化甲醇氧化机理[41]Figure 3 Proposed mechanism for the oxidation of methanol over highly dispersed vanadia supported on TiO2 |
RuOx催化剂在醇类催化氧化反应中应用广泛。Liu H等[44]研究发现, 负载RuOx催化剂中的晶格氧相较VOx等其他金属氧化物催化剂更易与甲醇氧化中间体上的氢结合, 能够在低温[(330~400)K]下催化甲醇的选择性氧化反应, 从而提高甲酸甲酯的选择性。实验对比了低温[(330~400)K]下, ZrO2、TiO2、SnO2、Al2O3和SiO2作载体时负载RuOx催化氧化CH3OH的效果, 结果表明, RuO2/SnO2, RuO2/TiO2和RuO2/ZrO2在393 K下甲酸甲酯选择性更好, 反应温度升高甲醇转化率升高, 甲酸甲酯选择性降低。甲醇氧化反应的转化率受催化剂晶格氧原子浓度影响, 其次氧化产物选择性与载体表面活性位点的性质有关。随后Liu H等[45]又通过实验探究了ZrO2表面的RuOx物种变化对RuO2/ZrO2催化剂催化性能的影响, 结果表明, 甲醇催化氧化反应产物中甲酸甲酯选择性随Ru表面密度的增加而降低(0.2 Ru·nm-2时最高, 约96.6%)。RuOx在钌表面密度低(< 0.4 Ru·nm-2)时在ZrO2表面高度分散并以
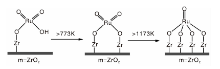 | 图4 不同焙烧温度下的RuO42-结构示意图[47]Figure 4 RuO42- structures calcined at different treatment temperatures |
ReOx、Fe2O3、CuO 等金属氧化物催化剂也被用于甲醇选择氧化制甲酸甲酯, 并表现出了优良的催化效果。Liu J等[48]制备了ReOx/CeO2催化剂, 通过原位傅里叶变换红外光谱研究了甲醇, 甲醛和甲酸甲酯在ReOx/CeO2催化剂上的反应机理, 证明甲醇在ReOx/CeO2催化剂表面吸附产生了表面甲氧基物质, 而后脱氢形成HCHO。吸附在催化剂表面的HCHO与气态的CH3OH反应形成二甲醛物质, 被晶格氧进一步氧化成甲酸盐, 甲酸盐物种继续与CH3OH反应生产甲酸甲酯。该反应中甲醇反应速率和甲酸甲酯选择性随Re含量的增加而增加, 在6.4%时选择性达到最大值, 此时在反应温度513 K下甲酸甲酯选择性达到90%。
Fe2O3具有酸性和氧化还原能力, 使得Fe2O3/SiO2催化剂也对甲醇氧化反应具有一定的催化作用[49], 在超临界二氧化碳中进行反应, 甲酸甲酯选择性可达60%。Fe2O3负载量低时在SiO2表面上分散度高, 催化剂表面活性位点的利用率高, 增强了对甲酸甲酯选择性。Fe2O3上的氧化性位点能够将表面吸附的甲氧基物种(Fe-OCH3)转化为甲酸盐物种(Fe-OOCH)和H2O, 甲酸盐物种(Fe-OOCH)与甲氧基(Si-OCH3或Fe-OCH3)继续反应产生甲酸甲酯。
甲醇光催化氧化制甲酸甲酯反应由于在绿色节能方面具有优越性, 相关研究也受到了广泛关注。Katherine R Phillips等[50]提出了在TiO2催化剂上甲醇两步反应制甲酸甲酯的过程, 吸附的甲醇与表面羟基反应生成甲氧基和水, 甲氧基在光催化产生的空位上氧化成甲醛, 随后甲醛在紫外光下生成HCO并迅速与表面吸附的甲氧基偶合生成甲酸甲酯。随后Liu Jie等[51]在探究甲醇光催化氧化反应时, 发现Cu/TiO2是一种新型高效的催化甲醇氧化生成甲酸甲酯的光催化剂。实验在室温[(15~45)℃]下利用紫外光照射装有Cu/TiO2催化剂的流动反应器, 并向其中通入甲醇和氧气合成甲酸甲酯, 甲酸甲酯的生成速率可以达到56.4 mmol·(g·h)-1。该反应中氧分子在Cu表面发生解离生成活性氧原子, 甲醇分子吸附在TiO2表面形成甲氧基, TiO2表面上被紫外光激发产生空穴-电子对, 吸附的甲氧基在光激发产生的空穴上被氧化为甲醛, 随后与表面吸附的甲氧基生成甲酸甲酯。紫外光激发的电子在TiO2和CuO间接触界面迁移, 带负电荷的Cu纳米颗粒更利于分子氧的离解吸附, 加快了甲醇在Cu/TiO2催化剂上的氧化反应。
Shi Q等[52]通过在TiO2纳米片上负载CuO纳米颗粒, 合成了CuO/TiO2光催化剂。该催化剂最大程度地减少了光生电子-空穴的重组, 在温和条件下表现出优异的光催化性能。实验利用5%CuO/TiO2光催化剂在室温[(25~45)℃]下, 使用波长为365 nm的紫外线照射反应时, 得到了约95%的甲醇转化率, 甲酸甲酯选择性也超过了85%。且反应副产物只有CO2, 达到了绿色高效的催化效果。此外他们还首次制备出了CuO/TiO2纳米针状体(CuO/TiO2-P)用作紫外光下甲醇氧化的光催化剂[53]。该方法制备的7%CuO/TiO2-P催化剂在25 ℃下具有97%的甲醇转化率和83%的甲酸甲酯选择性。CuO/TiO2-P复合材料中的CuO和TiO2间形成的p-n结改善了反应系统的电荷分布, 充当了将电子在催化剂表面转移的桥梁, 提高了催化剂表面O2的解离速率, 使得催化活性得到增强。Re、Fe、Cu金属氧化物催化剂不仅具有高选择性, 还具有较V、Ru催化剂更高的转化率, 此外Fe、Cu金属成本低, 且CuO光催化反应的高活性具备了工业推广的价值。
甲醇选择性氧化制甲酸甲酯部分金属氧化物催化剂性能对比见表2。
| 表2 金属氧化物催化剂催化氧化甲醇为甲酸甲酯性能 Table 2 Metal oxide catalysts for methanol oxidation to methyl formate |
通过表2可以看出, 相较于贵金属催化剂, TiO2、CuO/TiO2、CuO/TiO2-P这类光催化剂对甲醇氧化制甲酸甲酯反应的转化率和选择性具有明显的优越性, 未来有广阔的应用前景和研究价值, 其他金属氧化物催化剂如Fe2O3/SiO2、ReOx/CeO2、RuOx/m-ZrO2等也具有较好的催化性能, 但其存在反应温度高, 甲醇转化率低等问题。
甲醇选择氧化制甲酸甲酯对甲醇下游产品的深度开发以及甲酸甲酯生产具有重要的科研价值和应用价值。Pt、Au、Pd等贵金属及其合金催化剂能够通过表面产生的活性氧物种催化甲醇氧化, 研究针对O2的吸附解离效率提高展开, 通过改变金属结构和控制纳米颗粒尺寸来改变吸附性, 及增强催化材料金属间电子转移的方法, 降低O2在催化剂表面的结合能, 保证活性氧原子和中间体的脱附和表面活性位点的利用率, 避免甲醇的深度氧化, 提高反应效率。贵金属催化剂能够在低温下催化甲醇选择氧化, 但仍存在甲醇转化率低和深度氧化, 此外催化剂的高成本也是阻碍其工业推广的原因。
金属氧化物催化剂的氧化物结构及酸碱性影响其反应活性。通过金属元素的价态变化实现金属位点的氧化性, 同时金属氧化物结构也对选择性产生影响, 反应遵循Mars-van Krevelen机理; 催化剂的酸性位点催化甲醇的酯化, 金属氧化物表面酸碱两性位点能够促进中间体酯化产生甲酸甲酯, 具有较高选择性。研究发现可以通过添加硫酸盐和Cl-等酸根离子改性的方法, 增强催化剂的酸性, 调节甲醇和中间体的吸附性, 提高甲酸甲酯选择性。光催化反应机理的研究, 为催化效果的提高提出了新的方向。目前甲醇选择氧化制甲酸甲酯的催化剂种类及反应路径仍需要被更多地开发以适应工业应用的需求, 为提高反应速率和甲酸甲酯选择性, 同时探索更加温和的反应条件, 提出以下展望:
(1)催化剂体系方面。调控甲醇氧化双功能催化剂的氧化性和酸性, 使反应中间体甲醛的生成速率与酸性位点上甲醇转化速率达到平衡, 提高甲酸甲酯选择性。利用合金以及具有特殊电子结构的材料促进中间体与产物的脱附, 减少甲醇的深度氧化反应, 提高活性位点利用效率。
(2)新型催化反应方面。利用TiO2的特殊光催化性能进行的新型光催化反应, 紫外光激发空穴-电子对促进催化剂上的电子迁移, 是未来醇类氧化的重要发展方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|


