金属氧化物催化剂是一类常用的氢气催化氧化剂,通过程序控温-在线质谱分析技术对工业金属氧化物催化剂进行初步筛选,研究了两种氢气还原温度较低的金属氧化物催化剂的氢气催化氧化性能。结果表明,活性CuO颗粒具有较大的比表面积,其氢气催化活性明显高于其他CuO催化剂。在预热温度、氢气浓度和反应空速相同条件下,霍加拉特剂( ϕ1 mm× 3 mm)的氢气转化率大于或等于活性CuO颗粒[ ϕ2 mm× (3~5) mm]。
A temperature programmed on-line mass spectrometry was used to screen commercially available metal oxides.Two metal oxide catalysts with low hydrogen oxidation temperature were selected for hydrogen catalytic oxidation performance investigation.The results show that the hydrogen catalytic oxidation activity of active CuO particles is significantly higher than that of other CuO catalysts due to its greater specific surface area.The hydrogen conversion over hopcalite catalyst(φ 1 mm× 3 mm) is greater than or equal to that of active CuO catalyst(dimensions of φ 2 mm × 3-5 mm) under the same preheating temperature,hydrogen concentration and GHSV.
氚是一种放射性元素, 直接排放会对环境造成污染。将氚催化氧化为水是目前处理含氚尾气的一种主要方法[1, 2]。氚与氢为同位素, 具有相同的化学性质, 一般采用氢气代替氚气进行催化氧化研究[3]。
目前, 常用的氢气催化氧化剂主要有贵金属催化剂和金属氧化物催化剂。其中, 贵金属催化剂反应温度低, 氢气转化率高, 但成本较高, 且只能用于含氧气氛。Bixel J C等[4]采用Pd作为活性元素制备了除氚催化剂, 在177 ℃时比活度1.85× 109 Bq· m-3的氚转化率可达99.98%; 金属氧化物催化剂具有材料简单易得, 反应放热量较低, 在无氧气氛和有氧气氛均可使用等优点, 但反应温度相对较高。郑振华等[3]比较了Ag-X、H506-2和CuO催化剂的氢气催化氧化性能, 结果表明, Ag-X的使用温度应控制在约200 ℃; H506-2在温度高于300 ℃时, 可以使氢气的单程氧化效率达到99%; CuO在500 ℃时才能使氢气完全反应。龙兴贵等[5]测试了霍加拉特剂的氢气催化氧化效率, 发现在400 ℃时对氢气的氧化效率接近100%。
本文通过程序控温-在线质谱分析技术对常用的几种工业金属氧化物试剂或催化剂进行初步筛选, 研究筛选出的金属氧化物催化剂的氢气催化氧化性能。
Ag2O颗粒, 光谱纯, 上海试剂厂; Ag2O粉末, 分析纯, 西安化学试剂厂; CuO丝, 分析纯, 天津福晨化学试剂有限公司; CuO粉末, 分析纯, 天津市博迪化工有限公司; 活性CuO颗粒, 圆柱状[ϕ 2 mm× (3~5) mm], 比表面积约80 m2· g-1, 湖南敏锶壮科技有限公司; 鳞片状CuO, 片径1 mm, 湖南敏锶壮科技有限公司; 霍加拉特剂, 圆柱状(ϕ 1 mm× 3 mm), 比表面积(200~300) m2· g-1, 默锐机械有限公司; 氢气标准气, 平衡气为氮气, 大连大特气体有限公司。所有试剂及气体均未处理, 直接使用。
化学吸附仪, AutoChem Ⅱ , 美国麦克仪器有限公司; 在线质谱, Cirrus 2, 英国mks公司; D07-19B、D07-9E质量流量控制器, 北京七星华创流量计有限公司; Model5060氢气传感器, 量程0~4.000%, 测量精度≤ ± 0.005%或读数的10%, 响应时间T90< 30 s, 苏州正秦电气有限公司。
程序控温-在线质谱测试在陕西师范大学测试分析中心采用化学吸附仪-在线质谱联用设备进行。样品装填量约0.5 g, 升温速率10 ℃· min-1, 10%H2气氛(其余为Ar), 流量50 mL· min-1。
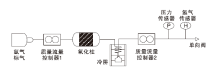
氢气催化氧化性能测试采用自建装置进行, 装置示意图如图1所示。其中, 质量流量控制器1用于控制进气流量, 质量流量控制器2用于测试尾气流量, 不对流量进行控制。具体质量流量控制器的型号根据流量进行选择:流量小于 5 L· min-1和20 L· min-1时分别选择量程为5 L· min-1和20 L· min-1的D07-19B质量流量控制器, 流量大于20 L· min-1时选择量程为70 L· min-1的D07-9E质量流量控制器; 氢气传感器采用Model5060氢气传感器; 氧化柱尺寸为ϕ 内36 mm× 196 mm, 容积约199.5 cm3, 氧化柱内金属氧化物催化剂的装填量见表1, 其中活性CuO颗粒和霍加拉特剂的装填量分别约242 g和166 g; 冷阱通过JEIO TECH RW3-3035冷却机提供, 冷阱温度10 ℃; 实验装置尾端设置单向阀, 以避免大气对实验的干扰。
| 表1 金属氧化物催化剂的装填量 Table 1 Loadings of the metal oxide catalysts |
实验过程:将氧化柱预热至设定温度, 然后将预热的氢气标准气以一定流量通入装有金属氧化物催化剂的氧化柱, 反应后的尾气通过冷阱除去多余水, 之后分别用质量流量控制器和氢气传感器测试尾气的流量和氢气含量。金属氧化物催化剂的氢气催化氧化性能用氢气转化率表示。氢气转化率根据氢气传感器稳定后的读数和式1进行计算。
式中, η 为氢气转化率; x1和x2分别为进气氢气浓度和尾气氢气浓度; f1和f2分别为进气流量和尾气流量, L· min-1。
为筛选出氢气反应活性较高的金属氧化物催化剂, 对几种较为常用的工业金属氧化物试剂或催化剂进行程序控温-在线质谱分析, 结果见图2。分析气氛为10%氢气(平衡气为Ar)气氛。
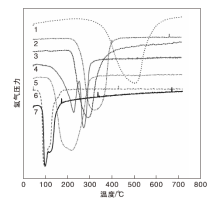 | 图2 程序控温-在线质谱分析结果 1.CuO粉末; 2.CuO丝; 3.鳞片CuO; 4.霍加拉特剂; 5.活性CuO颗粒; 6.Ag2O颗粒; 7.Ag2O粉末Figure 2 Results of the temperature programmed on-line mass spectrometry |
由图2可以看出, 几种金属氧化物催化剂氢气还原峰值温度从低到高顺序依次为Ag2O颗粒、Ag2O粉末、活性CuO颗粒、霍加拉特剂、鳞片状CuO、CuO丝和CuO粉末。其中, Ag2O颗粒、Ag2O粉末、活性CuO颗粒、鳞片状CuO、CuO丝和CuO粉末各有1个氢气还原峰, 峰值温度分别约为97 ℃、98 ℃、219 ℃、282 ℃、322 ℃和485 ℃, 霍加拉特剂有2个氢气还原峰, 峰值温度约228 ℃和273 ℃, 分别对应氢气与霍加拉特剂中吸附氧和晶格氧的反应[6]。
由图2还可以看出, Ag2O颗粒和Ag2O粉末的氢气还原峰的形状和峰值温度均较为接近, 这主要是因为二者主要成分相同(均为Ag2O); 活性CuO颗粒、鳞片状CuO、CuO丝和CuO粉末的主要成分也相同(均为CuO), 但氢气还原峰的形状和峰值温度均存在较为明显的差异。其中, 活性CuO颗粒的氢气还原峰值温度明显更低, 这主要与活性CuO颗粒主要成分为无定型CuO, 具有较大的比表面积(约80 m2· g-1)和较多的活性位点有关。
测试的几种金属氧化物催化剂中, Ag2O颗粒和Ag2O粉末的氢气还原温度最低, 但成本较高; 剩余几种金属氧化物催化剂中, 活性CuO颗粒和霍加拉特剂的氢气还原温度最低, 且均为工业化产品, 成本较低。从反应温度、成本等方面考虑, 活性CuO颗粒和霍加拉特剂较适宜用作氢气催化氧化剂。
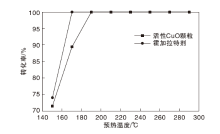
氢气浓度1.5%, 反应空速601.5 h-1, 测试活性CuO颗粒和霍加拉特剂的氢气催化氧化性能, (150~290) ℃氢气转化率与预热温度的关系见图3。
由图3可以看出, 活性CuO颗粒的氢气转化率在预热温度150 ℃和170 ℃时分别为71.63%和89.49%, 在预热温度不小于190 ℃时为100.00%。表明活性CuO颗粒在190 ℃时即可使氢气完全转化为水, 该值远低于郑振华等[3]报道的CuO催化剂的氢气完全转化温度(500 ℃)。从程序控温-在线质谱分析结果可以看出, CuO粉末的氢气还原峰值温度约485 ℃, 与郑振华等的报道结果较为接近。据此推测, CuO催化剂氢气完全转化温度存在明显差别的原因可能是本文所采用的催化剂与郑振华等采用的催化剂在比表面积和有效成分的存在状态等方面不同。
由图3还可以看出, 霍加拉特剂的氢气转化率在预热温度150 ℃时为74.06%, 在预热温度不小于170 ℃时为100.00%。对比活性CuO颗粒和霍加拉特剂的氢气催化氧化性能, 可见在相同预热温度下, 霍加拉特剂的氢气转化率大于或等于活性CuO颗粒。
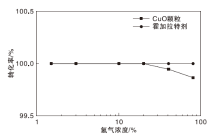
预热温度190 ℃, 反应空速300.8 h-1, 氢气转化率与氢气浓度的关系见图4。
由图4可以看出, 活性CuO颗粒的氢气转化率在氢气浓度不超过20.1%时为100.00%, 在氢气浓度分别为60.2%和80.4%时分别为99.92%和99.87%。而霍加拉特剂的氢气转化率在氢气浓度1.5%~80.4%均为100.00%。表明在相同氢气浓度下, 霍加拉特剂的氢气转化率大于或等于活性CuO颗粒。
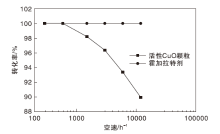
预热温度190 ℃, 标准气氢气浓度3.0%, 氢气转化率与空速的关系见图5。
由图5可以看出, 在反应空速300.8 h-1和601.5 h-1时, 活性CuO颗粒的氢气转化率均为100.00%, 随着反应空速的继续增加, 其氢气转化率呈下降趋势, 在反应空速达12 030 h-1时, 氢气转化率为89.94%。而霍加拉特剂的氢气转化率在反应空速(300.8~12 030) h-1均为100.00%, 表明在相同反应空速下, 霍加拉特剂的氢气转化率大于或等于活性CuO颗粒。
在预热温度、氢气浓度和反应空速相同条件下, 霍加拉特剂的氢气转化率均大于或等于活性CuO颗粒。结合图2, 霍加拉特剂与氢气反应的峰值温度略高于活性CuO颗粒, 分别约228 ℃和219 ℃, 相差不大。但是, 霍加拉特剂开始与氢气发生反应的温度明显低于活性CuO颗粒, 分别约65 ℃和120 ℃。表明温度较低时, 霍加拉特剂与氢气反应的活性大于活性CuO颗粒。同时, 霍加拉特剂比表面积大于活性CuO颗粒, 比表面积分别为(200~300) m2· g-1和约80 m2 g-1, 较大的比表面积有利于催化氧化剂与氢气发生反应。因此, 相同条件下, 霍加拉特剂的氢气转化率更高。此外, 霍加拉特剂与活性CuO颗粒的尺寸不同, 尺寸分别为ϕ 1 mm× 3 mm和ϕ 2 mm× (3~5) mm, 微观结构也可能存在差别, 这些均会对气体传质产生影响, 进而影响氢气转化率。
(1) 通过程序控温-在线质谱分析技术对几种常用的工业金属氧化物试剂或催化剂进行了初步筛选, 发现氢气还原峰值温度从低到高顺序依次为Ag2O颗粒、Ag2O粉末、活性CuO颗粒、霍加拉特剂、鳞片CuO、CuO丝和CuO粉末。
(2) 活性CuO颗粒的氢气催化活性明显高于其他CuO催化剂。
(3) 在相同预热温度、氢气浓度和空速条件下, 霍加拉特剂(ϕ 1 mm× 3 mm)的氢气转化率均大于或等于活性CuO颗粒[ϕ 2 mm× (3~5) mm]。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|